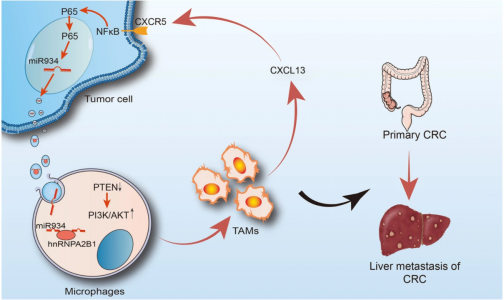
肿瘤相关巨噬细胞(TAM)和外泌体在转移前微环境的形成中至关重要。近日,来自复旦大学附属肿瘤医院李大卫、陈治宇、李桂超课题组的研究团队在Journal of Hematology & Oncology杂志上发表文章,揭示了结直肠癌(CRC)来源的miR-934通过调节CRC细胞与TAM之间的通讯来促进结直肠癌肝转移,揭示了肿瘤和TAM通过外泌体的介导在肿瘤转移微环境形成中的作用,也为继发性肝癌提供了理论依据。
尽管手术、化疗、靶向治疗和免疫治疗的联合应用在一定程度上提高了结直肠癌(CRC)的临床治疗疗效,但结直肠癌的发病率仍然位居第三,是全球第二大癌症相关死亡原因。大约50%的结直肠癌的癌症相关死亡是由结直肠癌肝转移(CRLM)引起的。CRLM是一个多步骤的生物学过程,由关键基因调控,介导肿瘤细胞和肿瘤微环境(TME)之间的联系。因此,探索转移驱动的关键基因及其机制,以及确定有效的治疗靶点来阻断转移,有助于制定有效的治疗策略,改善CRLM患者的预后。
据报道,原发性肿瘤在继发器官和组织部位为随后的转移创造了有利的TME,这可以通过原发性肿瘤衍生因子、肿瘤动员的骨髓源性细胞和局部基质成分的复杂相互作用来启动和建立。人们普遍认为来自TME的细胞参与了肿瘤转移。越来越多的证据表明,外泌体通过将信号肽、非编码RNA或DNA转移到邻近的细胞或组织中,在TME重编程和肿瘤转移中起着关键作用。存在于外泌体中的miRNAs可被邻近或远处的细胞吸收,并调节受体细胞。miRNAs作为17–24 nt小非编码RNA的主要类型,通过与3′-非翻译区域(3′-UTRs)结合来调节靶mRNAs的表达,从而促进各种癌症的进展。外泌体miRNAs的失调会影响癌细胞与TME之间的通讯。巨噬细胞是肿瘤内和周围最丰富的浸润性免疫相关基质细胞,通过不同的刺激,可以极化为经典激活的M1巨噬细胞或交替激活的M2巨噬细胞。肿瘤相关巨噬细胞(TAM)被认为是M2型的,存在于TME中,通过与肿瘤细胞相互作用影响各种癌症的转移。肿瘤细胞与M2巨噬细胞之间的通信已被广泛研究,然而,在结直肠癌中,肿瘤细胞激活M2巨噬细胞的机制尚不清楚,在CRLM中更不清楚。
在本研究中,研究人员探索了miR-934在CRLM中的表达模式,并评估了CRC来源的外泌体是否能通过miR-934的分泌来诱导M2巨噬细胞极化。研究团队采用透射电镜和超速离心证实了外泌体的存在,并用体内和体外实验鉴定外泌体miR-934的作用。通过RNA下拉实验、双荧光素酶报告实验等方法对外泌体miR-934调节CRC细胞与M2巨噬细胞间通信机制进行探索。
结果显示,研究团队首次证实miR-934在结直肠癌中异常高表达,尤其是在CRLM中,与CRC患者预后不良相关。然后,研究人员验证了CRC细胞来源的miR-934通过下调PTEN表达和激活PI3K/AKT信号通路,诱导M2巨噬细胞极化。此外,hnRNPA2B1介导miR-934包装到CRC细胞的外泌体中,然后将miR-934转移到巨噬细胞中。有趣的是,极化的M2巨噬细胞可以通过分泌CXCL13来诱导转移前微环境的形成并促进CRLM的形成,从而激活CRC细胞中CXCL13/CXCR5/NFκB/p65/miR-934正反馈通路。该发现提出了一种CRLM特异性的新生物标志物,并有助于开发预测CRLM风险的新策略。
参考文献:Tumor-derived exosomal miR-934 inducesmacrophage M2 polarization to promote liver metastasis of colorectal cancer. JHematol Oncol. 2020 Nov 19;13(1):156.