在IL-6高表达的乳腺癌中,早期髓源性抑制细胞(eMDSCs)的发展与SOCS3缺失依赖的JAK/STAT信号通路的过度激活有关。来自天津医科大学附属肿瘤医院于津浦教授课题组的研究人员发现,肿瘤来源的外泌体miR-9和miR-181a传递到eMDSCs中,分别干扰SOCS3和PIAS3进而调节JAK/STAT信号通路,为IL-6高表达的乳腺癌治疗提供潜在的治疗靶点。该研究发表于Oncogene杂志上。
肿瘤免疫逃逸和转移是恶性肿瘤发生发展的关键环节,是肿瘤免疫治疗失败的原因之一。许多免疫抑制细胞通过诱导免疫抑制微环境促进肿瘤的生长和侵袭。髓源性抑制细胞(MDSCs)是一种由未成熟骨髓细胞组成的异质性细胞群体,在肿瘤逃避宿主免疫监视方面发挥着重要作用。MDSCs具有不同的表型和功能。在人类细胞群体中,CD11b+ HLA-DR-/lo CD14+ CD15- 和CD11b+HLA- DR-/lo CD14- CD15+分别被命名为M-MDSCs和PMN-MDSCs。然而,在小鼠中,M-MDSCs和PMN-MDSCs的特征分别为CD11b+ Ly-6G- Ly6Chi和CD11b+ Ly-6Ghi Ly6C-。早期MDSCs(eMDSCs)是新近发现的具有Lin- HLA- DR- CD33+表型的人类MDSCs亚群,但目前对eMDSCs的研究报道较少。
在晚期黑色素瘤患者中,eMDSCs被鉴定为CD33+ CD11b+HLA- DR- 表型,具有免疫抑制性特征,与伊皮利木单抗治疗的长期生存率和客观临床反应性呈负相关。研究团队在人类乳腺癌中曾发现了一个表型为Lin- HLA- DR- CD45+ CD33+CD13+ CD14- CD15-的未成熟eMDSCs亚群,并确定了其在小鼠中的表型为CD11b+ Gr-1- F4/80- MHC-II-,这两个亚群都通过有效的免疫抑制体内外T细胞,显著促进肿瘤生长和转移。
eMDSC,M-MDSC和PMN-MDSC均可通过抑制肿瘤免疫来促进肿瘤进展。与传统的M-MDSCs和PMN-MDSCs相比,eMDSCs在表型生物标志物上显示出明显的差异,并持续保持较差的分化状态。研究发现,eMDSCs比CD11b+ Gr-1+MDSCs具有更强的免疫抑制能力。其他研究人员发现,从荷瘤动物中新鲜分离的粒细胞/巨噬细胞祖细胞和普通髓样祖细胞均具有抑制T细胞增殖的能力,并且比常规MDSC具有更强的抑制能力。CD115+ Ly6C- MDSC比CD115+Ly6C+ MDSC更不成熟,并表现出更高的抑制活性。这些研究表明,eMDSCs具有独特的未成熟表型和有效的免疫抑制能力,在促癌过程中起着至关重要的作用。但是,尚不清楚eMDSCs在调节癌症中的潜在机制。
该研究团队此前曾发现IL-6诱导的SOCS3缺乏是协调eMDSCs发生的关键分子事件,刺激了JAK/STAT信号通路的持续激活。SOCS3是JAK/STAT信号通路的主要负反馈调节因子。 SOCS3的组成型缺陷在多种肿瘤中被发现,并且与恶性肿瘤细胞的增殖和迁移有关。SOCS家族基因的表观遗传失调和转录后修饰,如启动子甲基化和microRNA(miRNA)调控,是癌症中基因沉默的主要原因。在胆管癌、头颈部鳞状细胞癌、巴雷特食管腺癌和肺癌中观察到SOCS3甲基化程度升高。据报道,miR-203和miR-19a-3p可以抑制人乳腺癌细胞和胰腺β细胞中SOCS3的表达。但是,除了一项研究表明miR-30a通过靶向SOCS3诱导B细胞淋巴瘤小鼠中常规CD11b+Gr-1+ MDSC的扩增和激活外,很少有研究关注在eMDSC中SOCS3的表观遗传失调和翻译后修饰。
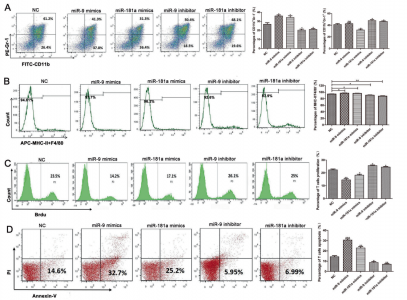
在这项研究中,研究人员评估了SOCS3启动子区域的甲基化状态和eMDSC中SOCS3相关miRNA的表达,并研究了肿瘤外泌体miRNA介导的转录后调控如何影响JAK/STAT信号通路和eMDSC的发展。通过使用miRNA芯片,研究人员筛选了仅在eMDSCs中上调并且与SOCS3表达成反比的miR-9和miR-181a。这两种miRNA均能促进未成熟eMDSC的扩增,并在小鼠和人细胞中大规模抑制T细胞免疫。此外,miR-9和miR-181a通过增强eMDSCs原位浸润来促进4T1肿瘤生长和免疫逃逸。进一步发现,miR-9和miR-181a通过分别抑制JAS/STAT信号通路负反馈回路中的两个关键调节因子SOCS3和PIAS3来刺激eMDSCs的发生。eMDSCs中升高的miR-9和miR-181a来源于肿瘤来源的外泌体,阻断外泌体释放可以完全减弱miRNA介导的对eMDSCs发生的调节。总之,这项研究结果表明,肿瘤外泌体来源的miR-9和miR-181a分别通过靶向SOCS3和PIAS3激活了JAK/STAT信号传导途径,从而促进了eMDSCs的扩增,这可能为高IL-6表达的乳腺癌提供了潜在的治疗靶点。
图:MiR-9和MiR-181a促进小鼠eMDSCs的扩增和免疫抑制功能。
参考文献:Jiang M, Zhang W, Zhang R, Liu P, Ye Y, Yu W, Guo X, Yu J. Cancer exosome-derivedmiR-9 and miR-181a promote the development of early-stage MDSCs via interferingwith SOCS3 and PIAS3 respectively in breast cancer. Oncogene. 2020 May 12.[Epub ahead of print]