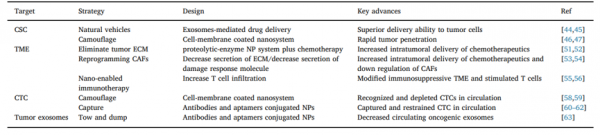
胰腺癌具有高度转移特性,患者生存期短和死亡率高。纳米药物可用于药物输送,也为靶向肿瘤转移的提供了可能。近日,来自中南大学附属湘雅二医院向大雄教授课题组的研究人员在Journal of Controlled Release杂志上发表综述,概述了胰腺癌转移相关的原因以及基于纳米药物的应对策略,同时还讨论了其在临床转化中的挑战。胰腺癌是最致命的实体恶性肿瘤之一,5年生存率非常低(5-7%)。尽管胰腺癌的总体发病率较低(约3%),但在美国胰腺癌是导致癌症死亡的第四大常见原因,而且男女的死亡率均在不断上升。据估计,到2030年,胰腺癌(最常见为胰腺导管腺癌(PDAC),约占90%)将成为癌症相关死亡的第二大原因,因此需要开发更有效的治疗方法并用于临床转化。PDAC的不良预后主要是由于缺乏早期筛查、检测和有效干预手段。首先,由于缺乏特定的生物标志物,在高危人群中缺乏早期筛查PDAC的灵敏方法,因此无法实现早期检测。其次,PDAC的临床症状通常表现得很晚,并且在晚期之前的临床表现是非特异性和模棱两可的,因此很难及早干预。第三,对晚期PDAC的姑息化疗方案,如吉西他滨,具有不利的药理特性,且疗效有限,且具有明显的毒性。尽管研究人员已开发了新的化疗方案对胰腺癌患者有所改善(例如FOLFIRINOX能显著延长中位生存期),总体存活率略有提高,但手术切除仍是PDAC的首选治疗方案,。然而,由于在发现时便诊断为晚期,大多数PDAC患者(约80%)被认为不适合手术切除,其特征是淋巴结和脉管系统浸润以及远处转移,例如肝、肺和腹膜转移等。更严重的是,转移性复发通常在手术后发生,其5年生存率仍停留在30%左右。因此,在没有干预转移策略的情况下实现PDAC的治愈是不可能的。在最近的几十年中,纳米技术显示出巨大的潜力,可以满足预防和治疗疾病的迫切需求,特别是在癌症领域。随着我们对参与PDAC进程的病理生物学和信号传导途径的了解,目前人们已开发出各种纳米级材料和生物材料来治疗疾病并在实验研究中显示出优异的效果,但是转移性PDAC仍然是一个重大挑战。在这篇综述中,研究人员聚焦于针对不同转移阶段的纳米药物的进展,通过纳米药物靶向包括肿瘤干细胞、肿瘤微环境、循环肿瘤细胞和肿瘤外泌体进行PDAC的诊断和治疗(图1)。这种基于纳米药物的策略对靶向胰腺癌的转移更有偏向性,为将来改善胰腺癌治疗结果提供了途径。研究人员还强调,抗肿瘤转移的目标是杀死主要肿瘤微环境中的肿瘤干细胞(CSC),以防止其传播到血液中,同时靶向循环肿瘤细胞(CTC),防止转移灶的形成。随着对肿瘤进展的了解以及纳米药物和纳米技术的发展,人们注意到了肿瘤微环境(TME)和外泌体在转移中的作用,TME的重编程和通过纳米系统消除致癌外泌体是一个可能的策略,发挥抗肿瘤转移的功效。强调了对抗PDAC转移的潜在策略,即消除CTC和肿瘤外泌体。但是,以前的研究主要集中在乳腺癌或肺癌上,PDAC模型研究较少,这可能是由于原位模型的难度和患者生存期短所致。由于PDAC是一种致死性极强的疾病,死亡率不断增加,而且趋势令人沮丧,因此,应鼓励开展进一步的研究,并应努力致力于防止PDAC的转移。在综述里,研究人员也设想了基于纳米药物的策略对PDAC转移和改善结局的未来发展。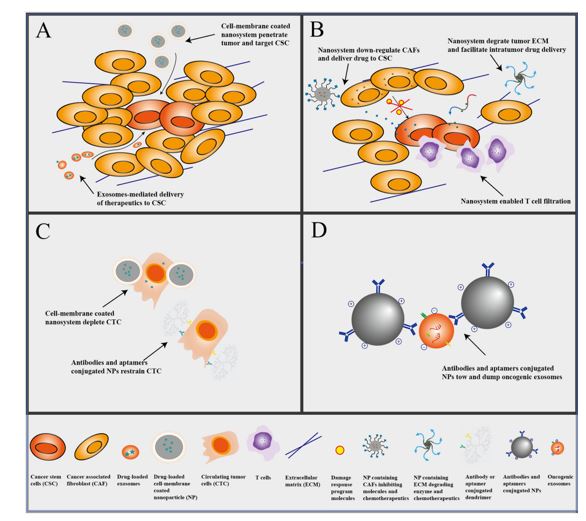
图2. 预防PDAC转移的基于纳米药物的策略示意图。(A)外泌体和细胞膜包被的纳米系统可以穿透肿瘤并将治疗药物靶向递送至肿瘤干细胞(CSC)。(B)纳米系统通过下调调节肿瘤微环境(TME)里的肿瘤相关成纤维细胞(CAF),降解细胞外基质或通过促进T细胞浸润而激活肿瘤免疫。(C)细胞膜包被的纳米颗粒可以识别并消耗循环中的循环肿瘤细胞(CTC),抗体或适体偶联的纳米颗粒(例如树状聚合物)也可以抑制CTC。(D)抗体或适体偶联纳米颗粒可以消除致癌性外泌体,防止转移前的微环境形成。参考文献:Li YJ, Wu JY, Wang JM, Xiang DX. Emerging nanomedicine-basedstrategies for preventing metastasis of pancreatic cancer. J Control Release.2020 Apr 10;320:105-111.外泌体资讯网 中南大学综述:基于纳米药物预防胰腺癌转移的新策略