近日,第四军医大学刘利教授等在Theranostics发表文章,报道了通过抑制外泌体被肝脏脾脏的吞噬细胞摄取,来提高外泌体到达靶器官(心脏)的效率,从而提高对心脏损伤的修复作用。 外泌体是直径为30-200 nm的小膜囊泡,由不同类型的细胞分泌,是细胞间通讯和药物输送的新型载体。作为天然来源的纳米囊泡,外泌体在体内有效地将外源RNA(siRNA和miRNA)递送至靶组织/细胞。尽管与现有合成系统相比具有多种优势,例如免疫原性较低和亲和力更高,但外泌体仍遭受单核吞噬细胞系统(MPS)的内吞作用,例如在肝脏和脾脏中,限制了它们在其他组织(如心脏)中的分布。由于心脏病的高发,急需改善外泌体的心肌细胞特异性递送。
外泌体是直径为30-200 nm的小膜囊泡,由不同类型的细胞分泌,是细胞间通讯和药物输送的新型载体。作为天然来源的纳米囊泡,外泌体在体内有效地将外源RNA(siRNA和miRNA)递送至靶组织/细胞。尽管与现有合成系统相比具有多种优势,例如免疫原性较低和亲和力更高,但外泌体仍遭受单核吞噬细胞系统(MPS)的内吞作用,例如在肝脏和脾脏中,限制了它们在其他组织(如心脏)中的分布。由于心脏病的高发,急需改善外泌体的心肌细胞特异性递送。
先前的研究主要集中在工程改造的靶向肽上,这些肽对心肌细胞具有更高的递送效率。但是,由于肝脏和脾脏仍然是工程化外泌体的主要靶器官,因此效率仍然受限。因此,必须避免减少外泌体在肝脏和脾脏中的非特异性积累,以增加外泌体向心脏和其他器官的递送效率。内吞作用的过程分为吞噬作用和胞饮作用。吞噬作用涉及相对较大(> 500 nm)颗粒的内在化,通常局限于特化的吞噬细胞。相反,所有细胞都表现出胞饮作用,通常分为网格蛋白依赖性内吞作用(CDE)、网格蛋白非依赖性内吞作用(CIE)和巨胞饮作用(MP)。网格蛋白是一种蛋白质,在包被的囊泡的形成中起主要作用。它形成由三个网格蛋白重链和三个轻链组成的三面蛇形状,它们自发地组装成篮子状的晶格,以驱动内吞作用的起始过程。网格蛋白重链1(Cltc)是一种由CLTC基因编码的蛋白质。Caveolin-1对于小窝的形成是必不可少的,并且会在膜的内陷中积聚,这对CIE过程至关重要。P1活化激酶1(PAK1)在MP中起重要作用,是一种62-68 kDa的丝氨酸/苏氨酸激酶,被确定为Rac和Cdc42(GTPase)的靶标,并调节肌动蛋白-肌球蛋白的细胞骨架。RhoA是小GTP酶Rho家族的成员,参与吞噬作用。鉴定脾脏、肝脏和心脏在外泌体内吞作用方面存在差异的关键基因,可能会有助于提高心脏靶向递送效率。这项研究发现Cltc在介导肝脏和脾外泌体的内吞作用中起着重要作用。通过采用阿霉素诱导的心脏损伤模型,证实了事先注射外泌体阻断剂可以显著地,特异性地阻断肝和脾中外泌体的内吞作用,从而促进注射的外泌体治疗剂有效地防止阿霉素对心肌的损害。方法:从细胞培养基中分离外泌体。通过荧光成像在体外和体内追踪荧光标记的外泌体。网格蛋白重链(Cltc)、cavolin1、Pak1和Rhoa(内吞的已知基因)的表达通过qPCR在各种细胞系和器官中进行了分析。通过Western印迹分析siRNA对Cltc的敲低效率。外泌体控制和外泌体阻断是通过电穿孔用siControl或siClathrin装载分离的外泌体而构建的,而外泌体治疗剂是通过用miR-21a装载分离的外泌体来构建的。阿霉素诱导的心脏毒性模型用于通过超声心动图验证基于外泌体的miR-21a递送的治疗效率。结果:外泌体优先聚集在肝脏和脾脏中,这主要是由于存在大量巨噬细胞所致。除了众所周知的吞噬作用外,有效的内吞作用还有助于巨噬细胞摄取外泌体。与其他胞吞相关基因相比,研究发现Cltc在巨噬细胞中高表达。因此,敲低Cltc显著降低了体外和体内巨噬细胞对外泌体的摄取。此外,事先注射外泌体阻断剂显著改善了外泌体向脾脏和肝脏以外器官的输送效率。与直接注射外泌体治疗药物相比,事先注射外泌体阻断剂在阿霉素诱导的心脏毒性小鼠模型中对心脏功能产生了更好的治疗效果。结论:巨噬细胞预先通过巨噬细胞阻断外泌体的内吞作用成功并有效地改善了继发性外泌体治疗药物在靶器官(如心脏)中的分布。既定的两步外泌体递送策略(先阻断外泌体的摄取,然后递送治疗性外泌体)将是基因治疗的一种有前途的方法。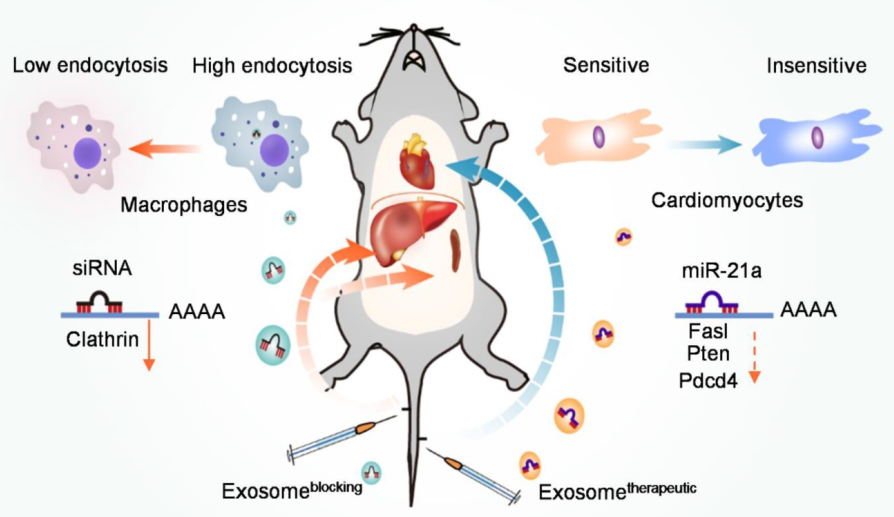 模式图Wan Z,Zhao L, Lu F, Gao X, Dong Y, Zhao Y, Wei M, Yang G, Xing C, Liu L. Mononuclear phagocyte system blockade improves therapeutic exosome delivery to the myocardium. Theranostics. 2020 Jan 1;10(1):218-230. doi:10.7150/thno.38198. eCollection 2020.
模式图Wan Z,Zhao L, Lu F, Gao X, Dong Y, Zhao Y, Wei M, Yang G, Xing C, Liu L. Mononuclear phagocyte system blockade improves therapeutic exosome delivery to the myocardium. Theranostics. 2020 Jan 1;10(1):218-230. doi:10.7150/thno.38198. eCollection 2020.外泌体资讯网 Theranostics:抑制单核吞噬细胞系统可改善治疗性外泌体向心肌的递送
 外泌体是直径为30-200 nm的小膜囊泡,由不同类型的细胞分泌,是细胞间通讯和药物输送的新型载体。作为天然来源的纳米囊泡,外泌体在体内有效地将外源RNA(siRNA和miRNA)递送至靶组织/细胞。尽管与现有合成系统相比具有多种优势,例如免疫原性较低和亲和力更高,但外泌体仍遭受单核吞噬细胞系统(MPS)的内吞作用,例如在肝脏和脾脏中,限制了它们在其他组织(如心脏)中的分布。由于心脏病的高发,急需改善外泌体的心肌细胞特异性递送。
外泌体是直径为30-200 nm的小膜囊泡,由不同类型的细胞分泌,是细胞间通讯和药物输送的新型载体。作为天然来源的纳米囊泡,外泌体在体内有效地将外源RNA(siRNA和miRNA)递送至靶组织/细胞。尽管与现有合成系统相比具有多种优势,例如免疫原性较低和亲和力更高,但外泌体仍遭受单核吞噬细胞系统(MPS)的内吞作用,例如在肝脏和脾脏中,限制了它们在其他组织(如心脏)中的分布。由于心脏病的高发,急需改善外泌体的心肌细胞特异性递送。 模式图
模式图



