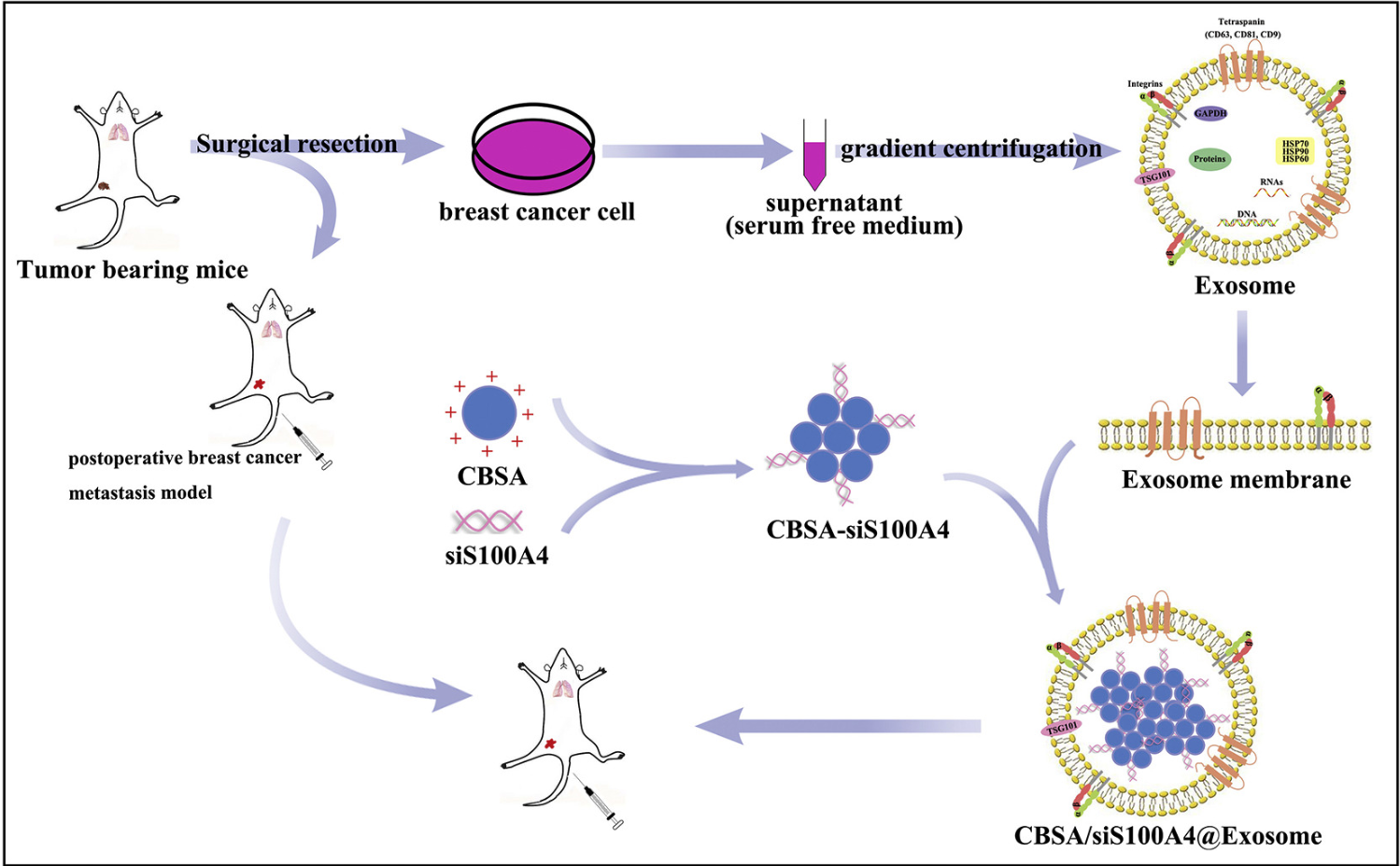
 术后三阴性乳腺癌的高复发和转移是乳腺癌相关死亡的主要原因。转移前的生态位的形成为肿瘤细胞提供了有利于原发肿瘤转移的微环境。来自南通大学药学院朱红艳课题组的研究人员在Journal of Controlled Release(IF=7.901)杂志上发表论文,开发了一种基于阳离子牛血清白蛋白和S100A4 siRNA的外泌体膜包被的仿生纳米颗粒,可能将成为抑制术后乳腺癌转移的一种有前途的策略。
术后三阴性乳腺癌的高复发和转移是乳腺癌相关死亡的主要原因。转移前的生态位的形成为肿瘤细胞提供了有利于原发肿瘤转移的微环境。来自南通大学药学院朱红艳课题组的研究人员在Journal of Controlled Release(IF=7.901)杂志上发表论文,开发了一种基于阳离子牛血清白蛋白和S100A4 siRNA的外泌体膜包被的仿生纳米颗粒,可能将成为抑制术后乳腺癌转移的一种有前途的策略。
乳腺癌是女性最常见的癌症类型,并且是癌症相关的死亡的第二大主要原因。三阴性乳腺癌(TNBC)是一种侵略性乳腺癌表型,其特征是缺乏雌激素(ER)、孕激素(PR)和人类表皮生长因子受体-2(HER-2)受体。转移性TNBC是乳腺癌治疗中的主要挑战,其生存率低下。乳腺癌转移涉及癌细胞从原发性肿瘤的扩散,癌细胞通过循环扩散在远端建立继发性肿瘤,从而导致肿瘤转移和高死亡率。癌细胞及其微环境之间的双向关联对于肿瘤归巢和生长至关重要。 Stephen Paget在1889年的一个重要里程碑认为癌症转移取决于“种子”(癌细胞)和“土壤”(宿主微环境)之间的相互作用。在远端器官的营养感受性微环境的形成有助于肿瘤细胞到达远端器官之前的扩散、存活和生长。因此,靶向转移前独特生态位和微环境是有效癌症治疗的关键。
研究表明,肿瘤外泌体的整合素可以决定肿瘤转移方向。由于乳腺癌细胞分泌的外泌体具有功能性表面整联蛋白(α6β4、α6β1),它们在富含laminin的肺微环境中共定位,因此具有出色的肺靶向特性。外泌体是直径为40至200 nm的细胞外膜囊泡,几乎所有类型的细胞都分泌该囊泡,稳定存在于体液中。作为天然载体,外泌体可用作药物递送载体,将外源RNA(siRNA和miRNA)在体内靶向靶组织或细胞,调节基因表达并抑制肿瘤的发展。原则上,外泌体作为siRNA传递载体比现有的药物传递系统具有多重优势。一方面,外泌体的大小适中可以使其逃脱体内的免疫吞噬作用。另一方面,外泌体可以来源于患者的自身细胞,从而将细胞毒性和免疫原性减至最小。
S100A4是S100家族的成员,并且是一种重要的与肿瘤转移相关的蛋白,可促进肿瘤的进展和转移。除了帮助转移前生态位的形成,S100A4上调还可以为恶性乳腺癌细胞建立有利的微环境。但是,靶向S100A4的有效方法仍然还未被开发。RNA干扰(RNAi)是一种由siRNA触发的转录后基因沉默方法,具有治疗遗传性疾病和癌症的潜力。众所周知,S100A4 siRNA(siS100A4)可以沉默S100A4表达并抑制肿瘤发生。
血清白蛋白具有无毒、无抗原和可生物降解的特性,已被广泛用作药物输送材料。在不破坏蛋白质结构的情况下,通过用阳离子氨基修饰牛血清白蛋白获得了具有新功能的阳离子牛血清白蛋白(CBSA)。具有最佳等电点(pI)值的CBSA作为siRNA载体已被广泛研究,而且CBSA带有正电荷,很容易穿过外泌体膜。
在这项研究中,研究人员开发了一种CBSA偶联的siS100A4以及由CBSA/siS100A4为核心的外泌体膜包裹的仿生纳米颗粒(CBSA/siS100A4 @Exosome)。CBSA/siS100A4 @Exosome自组装纳米颗粒尺寸均一,约为200 nm,而且外泌体膜可保护siRNA免受降解,表现出优异的生物相容性。体内研究表明,与CBSA/siS100A4 @liposome相比,CBSA/siS100A4 @Exosome对肺具有更高的亲和力,并且表现出显著的基因沉默效应,显著抑制了恶性乳腺癌细胞的生长。因此,研究人员开发的这种基于外泌体膜的纳米粒子,将有助于把治疗性siS100A4递送至肺部,在术后肺转移小鼠模型中起到了有效的癌症预防和治疗作用。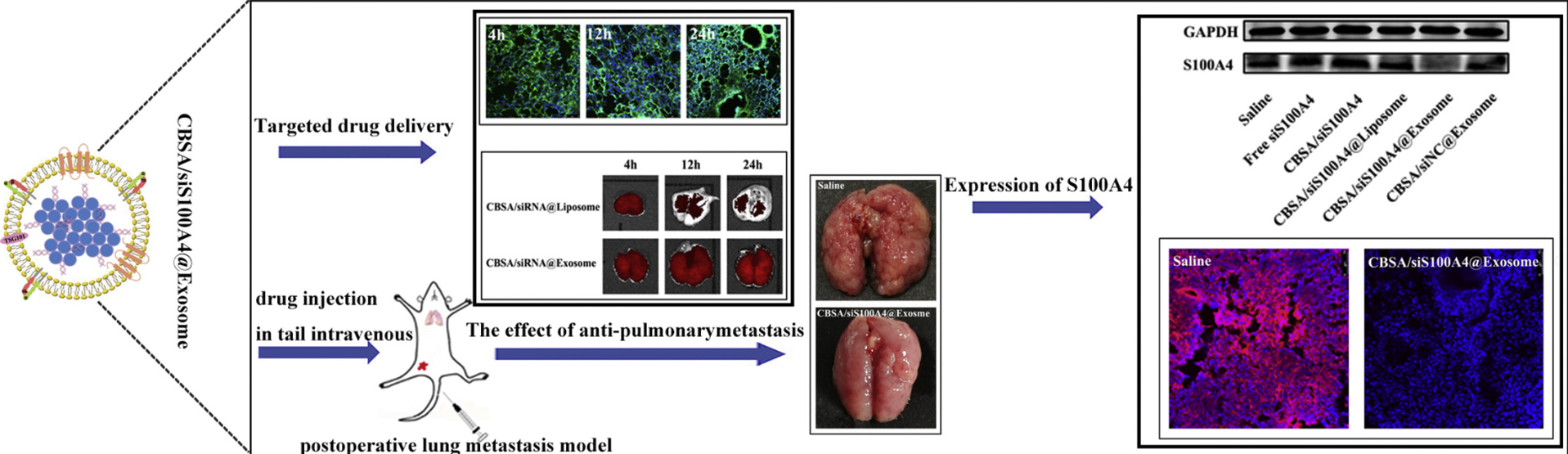
参考文献:Zhao L, Gu C, Gan Y, Shao L, Chen H, Zhu H. Exosome-mediated siRNA delivery to suppress postoperative breast cancer metastasis. J Control Release. 2019 Dec 9.doi: 10.1016/j.jconrel.2019.12.005.




