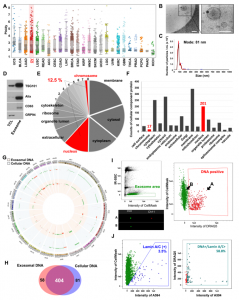
来自美国德州大学MD安德森癌症中心的Anil K. Sood课题组在近日发表在Science Advances杂志(影响因子12.804)上发表文章,揭示了细胞核的组分是如何进入外泌体的。
外泌体是小细胞外膜泡,介导生物学和细胞功能,包括细胞间的通讯。外泌体在早期的内体中产生,存储在多囊泡体(MVB)中,然后与质膜融合并释放外泌体到细胞外空间。四跨膜蛋白(一类主要的外泌体标志性蛋白质)位于内体、MVB和外泌体中,参与了多种成分分选进外泌体。外泌体在分泌它们的细胞或受体细胞中诱导不同生物学行为的能力取决于它们携带的成分。外泌体的成分是多种多样的,包括蛋白质和RNA。蛋白质和RNA(包括microRNA)的存在和丰度可以在多种情况下影响细胞行为,从免疫系统激活到抑制实体瘤生长和癌症转移等。
最近的研究表明,外泌体内存在基因组DNA(gDNA)和核蛋白。外泌体中gDNA的存在与细胞衰老和cGAS/STING炎症途径刺激等过程有关。此外,gDNA主要在癌细胞外泌体中检测到,而健康细胞外泌体中较少。矛盾的是,gDNA主要局限于细胞核,通常不与产生外泌体的细胞质MVB相互作用。因此,对外泌体中核成分存在的机制的了解仍然很少。
一种可能性涉及微核(micronuclei,MN,也叫卫星核,是真核类生物细胞中的一种异常结构,是染色体畸变在间期细胞中的一种表现形式,微核往往是各种理化因子,如辐射、化学药剂,对分裂细胞作用而产生),这是一种被核膜包围的细胞质结构,当细胞核未能适当地分离包括染色体的核成分时产生。这种错误的分离可能在有丝分裂期间发生,并可能受到DNA破坏剂(例如放射线)的驱动,从而导致染色体断裂。MN的存在是基因组不稳定性的替代标志物,这是癌症的标志(微核测试常用于辐射损伤、辐射防护、化学诱变剂、新药试验、食品添加剂的安全评价,以及染色体遗传疾病和癌症前期诊断等各个方面)。围绕MN的核包膜高度不稳定,最终分解并在细胞分裂过程中将其内容物暴露于细胞质中。MN的形成可以促进cGAS/STING途径的激活,从而导致针对衰老和癌细胞的炎症反应。
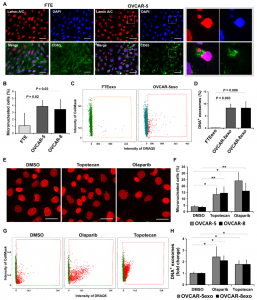
来自美国德州大学MD安德森癌症中心的Anil K. Sood课题组在近日发表在Science Advances杂志上的报道中确定了微核(MN)和包含核组分的外泌体(nExo)之间以前未知的关系。研究表明,使用遗传毒性药物诱导MN形成会促进nExo释放。该研究结果提出了外泌体中gDNA起源的机制,通过这种机制,MN崩溃后,其核内容物通过四跨膜蛋白穿梭进入MVB。此外,研究发现卵巢癌患者的外泌体gDNA反映了原发肿瘤的拷贝数变异(CNV)状态,可揭示DNA突变信息。因此,nExos可以作为重要的生物标记物,用于癌症检测和癌症患者的纵向监测。
总之,该研究确定了癌细胞微核(MN)和包含核组分的外泌体(nExo)形成之间的关系,MN是基因组不稳定的标志。成像流式细胞仪分析显示,来自10%癌细胞的外泌体的和来自<1%卵巢癌患者的血液和腹水的外泌体携带核内含物。用基因毒性药物处理可导致体内和体外MN和nExos升高。实验观察到多泡小体的前体和外泌体标志物,如四跨膜蛋白,与MN直接相互作用。此外,微核与含核组分的外泌体包含相似的蛋白成分。总的来说,这项工作提供了与nExos相关的新见解,这些见解对癌症生物标志物的发展具有影响。
卵巢癌外泌体的细胞核源成分的表征
促进微核的形成会增加携带DNA的外泌体的产生
参考文献:
Akira Yokoi, Alejandro Villar-Prados, Paul Allen Oliphint, Jianhua Zhang, Xingzhi Song, Peter De Hoff, Robert Morey, Jinsong Liu, Jason Roszik, Karen Clise-Dwyer, Jared K. Burks, Theresa J. O’Halloran, Louise C. Laurent and Anil K. Sood. Mechanisms of nuclear content loading to exosomes. Science Advances 20 Nov 2019: Vol. 5, no. 11, eaax8849 DOI: 10.1126/sciadv.aax8849
外泌体资讯网 Science子刊揭示细胞核组分进入外泌体的机制