近日,一项发表在Developmental Cell杂志(影响因子9.19)上的研究证明,胞外囊泡(特别是外泌体)清除胞内铁是驱动抗铁凋亡的重要机制。Nature Reviews Molecular Cell Biology杂志(影响因子43.351)进行了highlights报道。
Ferroptosis(铁凋亡)是在存在活性氧和游离铁的情况下由膜脂质的氧化损伤驱动的受调控的非凋亡性细胞死亡。铁凋亡的细胞死亡会导致缺血和变性疾病中病理性细胞丢失,并有可能诱发癌细胞死亡。在不同的细胞系之间,对铁凋亡的敏感性各不相同,但这些差异的机制尚不清楚。
各种刺激都可能引发铁凋亡,例如干扰谷胱甘肽过氧化物酶4(GPX4)介导的针对脂质氧化的防御作用,或细胞与细胞外基质(ECM)脱离。一些乳腺癌细胞系对由ECM脱离引起的铁凋亡具有抗性。筛选与该抗性有关的因素鉴定出prominin 2,该蛋白在ECM脱离时被上调;在用GPX抑制剂处理贴壁细胞后,prominin 2的表达也增加了,这种增加与细胞对铁凋亡的抵抗力有关。值得注意的是,prominin 2的下调增加了抗性细胞对铁凋亡的敏感性,而其在敏感细胞中的过表达促进了铁凋亡的抗性。因此,响应于铁凋亡刺激的prominin 2的表达可发挥保护细胞免受铁凋亡的作用。
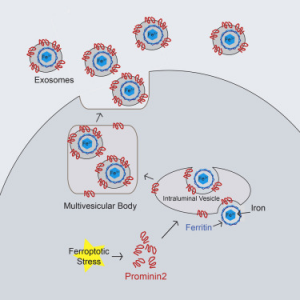
在用GPX抑制剂处理的铁凋亡抗性细胞中,prominin 2定位于多泡体(MVB),这种结构与外泌体的生物发生有关。prominin 2的表达导致MVB数量增加;因此,GPX抑制剂处理的细胞分泌大量的外泌体。在ECM脱离的铁凋亡抵抗的细胞中,也观察到MVB数量增加和外泌体分泌增加。 有趣的是,对MVB生物发生的抑制损害了GPX抑制剂诱导的对铁凋亡的抵抗力,表明Prominin 2诱导的外泌体分泌是针对铁凋亡的保护机制。
从GPX抑制剂处理过的铁凋亡抗性的细胞衍生的外泌体含有铁蛋白——一种重要的铁存储蛋白。此外,在诱导铁凋亡后,prominin 2水平与细胞游离铁的水平呈负相关。所以作者得出结论,外泌体是一种将铁从受铁凋亡刺激的细胞中排出的途径,从而保护细胞免于铁凋亡。
总之,该研究使用RNA-seq鉴定了有助于抗铁凋亡的基因,发现促铁凋亡的刺激物(包括抑制脂质氢过氧化物酶GPX4和从细胞外基质脱离)诱导了prominin2的表达,prominin2与脂质动态调节有关。Prominin2促进了乳腺上皮和乳腺癌细胞的抗铁凋亡。机制上,prominin2促进含铁蛋白的多泡体(MVB)和外泌体的形成,这些外泌体将铁转运出细胞,从而抑制了铁凋亡。这些发现表明,铁凋亡的抵抗可以由prominin2-MVB-外泌体-铁蛋白途径驱动,并且对铁稳态、细胞内运输和癌症具有广泛的影响。
模式图
要点:
- 促铁凋亡刺激诱导Prominin2的表达
- Prominin2促进上皮细胞和癌细胞的抗铁凋亡
- Prominin2促进含铁蛋白的多泡体和外泌体的形成
- 铁蛋白的细胞外转运可抑制铁凋亡
参考文献:
Brown, C. W. et al. Prominin2 drives ferroptosis resistance by stimulating multivesicular body/exosome-mediated iron export. Dev. Cell https://doi.org/10.1016/j.devcel.2019.10.007 (2019)
Strzyz, P. Iron expulsion by exosomes drives ferroptosis resistance. Nat Rev Mol Cell Biol (2019) doi:10.1038/s41580-019-0195-2
外泌体资讯网 Dev Cell:细胞通过外泌体排出铁导致铁凋亡抗性