土豆
LncRNA已成为间充质干细胞成骨分化过程中的新型调节因子。来自中南大学湘雅医院文霆课题组的研究人员在AGING杂志发表文章,阐明了骨质疏松症的发生与骨髓间充质干细胞分泌外泌体间的潜在功能相关性,揭示外泌体lncRNA MALAT1 通过miR-34c / SATB2轴增强成骨细胞活性并改善骨质疏松症。
骨质疏松症是全球范围内的重大医学问题和社会经济挑战,特征是骨量的全身性缺失,最终增加了脆性骨折的可能性。成骨细胞来自几种类型的骨骼干细胞,包括骨骼间充质干细胞(MSCs),其具有成骨分化潜能。MSC可分化为成骨细胞、软骨细胞、骨髓基质细胞、脂肪细胞、肌腱细胞和肌细胞。骨髓来源的间充质干细胞(BMSC)是新骨形成过程中的关键组成部分。从治疗的角度来看,BMSCs相对容易获得,移植后发生肿瘤的风险较低。在骨髓基质中,脂肪细胞有一个共同的前体,BMSC在分化至成骨和脂肪形成之间存在着失衡的状态,最终导致骨质疏松。因此,调节骨吸收和形成的关键途径可能是骨质疏松症治疗的方法。
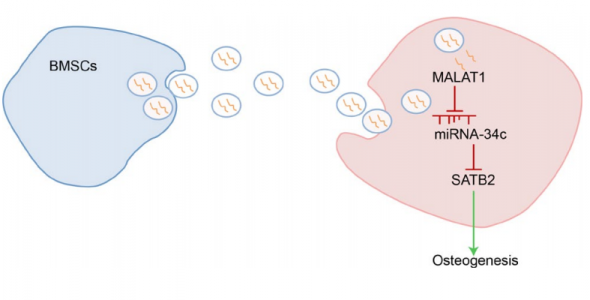
成骨细胞与破骨细胞之间的通讯是通过被膜包裹的小囊泡颗粒(称为外泌体)介导的。外泌体能够与循环途径中的周围细胞膜发生融合。研究表明,成骨细胞来源的外泌体调节破骨细胞的活性,外泌体在骨微环境和骨代谢中发挥重要作用。在MSC的成骨过程中,长链非编码RNA(lncRNA)正在作为新调节因子而出现。LncRNA MALAT1,也被称为NEAT2,已被确定是肺癌转移的预后生物标志物,并与其他几种人类肿瘤发生发展相关。研究发现,敲低MALAT1可以逆转正常成骨细胞hFOB1.19中由RANKL受体激活剂诱导的生长抑制。 MicroRNA(miRNA)也显示出调节骨骼中多个过程的功能,例如成骨细胞和破骨细胞分化。源自破骨细胞的含miRNA的外泌体选择性抑制成骨细胞的活性。miR-34c通过调节成骨细胞中的几个靶标(SATB2和Runx2)影响体内成骨细胞和破骨细胞的作用。据报道,增强的SATB2可以促进乙醇诱导的骨坏死患者骨髓间充质干细胞的成骨分化。研究还表明,BMSCs衍生的外泌体可能通过SATB2影响人类成骨细胞hFOB1.19的生物学特性。
为了进一步探索外泌体lncRNA潜在的分子生物学机制,研究人员通过生物信息学分析确定了miR-34c分别与lncRNA MALAT1和SATB2 mRNA 3'UTR结合。在该课题组前期研究中,他们发现MALAT1通过抑制miR-22-5p活性可以刺激成骨细胞hFOB1.19的破骨过程,该过程可以通过阻断VEGF信号传导和增强RANKL活性来减轻。因此,研究人员猜想,外泌体MALAT1可能通过调节miR-34c / SATB2轴在骨质疏松症的进展中起重要作用。
研究人员从原代BMSC中提取外泌体(BMSC-Exos),与人成骨细胞hFOB1.19共培养,然后评估了hFOB1.19细胞增殖、碱性磷酸酶(ALP)活性和矿化结节。结果显示,BMSC-Exos促进了成骨细胞中SATB2的表达,而SATB2沉默降低了成骨细胞的ALP活性和矿化结节。 MALAT1通过作为miR-34c海绵,促进SATB2的表达。此外,BMSC-Exos 中的MALAT1促进了成骨细胞活性。体内实验表明,在切除卵巢的小鼠中,miR-34c逆转了MALAT1的作用,而SATB2逆转了miR-34c的作用。综上所述,这项研究表明BMSCs衍生的外泌体lncRNA MALAT1通过介导miR-34c / SATB2轴增强了骨质疏松小鼠的成骨细胞活性。
参考文献:Yang X, Yang J, Lei P, Wen T. LncRNA MALAT1 shuttled by bone marrow-derived mesenchymal stem cells-secreted exosomes alleviates osteoporosis through mediating microRNA-34c/SATB2 axis. Aging (Albany NY). 2019. doi: 10.18632/aging.102264.