土豆
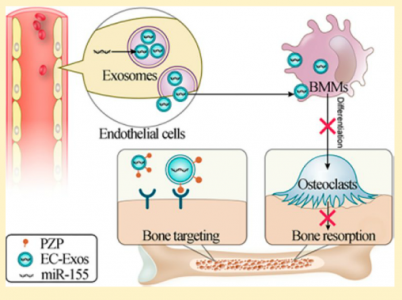
外泌体作为生物相容和生物活性纳米颗粒,在骨稳态中起重要作用。血管和骨稳态之间的关系密切,但血管内皮细胞分泌的外泌体在骨稳态中的作用尚不清楚。近日,来自海军军医大学附属长海医院苏佳灿课题组的研究人员在Nano Letters杂志(IF 12.080)上发表文章,他们发现血管内皮细胞分泌的外泌体特异性靶向骨组织,并通过递送miR-155在体外和体内促进骨质疏松症的恢复。
由成骨细胞介导的骨形成和破骨细胞介导的骨吸收的紧密协调,共同促进了骨骼的生长和重塑。过度的破骨细胞活性会导致骨吸收异常,引起一系列骨骼疾病,如骨质疏松症、类风湿性关节炎和骨硬化症等。抑制异常的骨吸收的一种策略是抑制破骨细胞的分化和活化。目前,已经有几种破骨细胞分化和活化抑制剂(如双膦酸盐、地诺单抗和降钙素等)已被批准用于临床。然而,这些药物由于不是特异性靶向骨骼,同时会对血管系统和其他器官造成不良副反应,因此需要开发具有高骨靶向能力和低毒性的新药和方法。
血管在骨骼系统的形成和重塑中起着重要作用。骨骼系统中血管网络的生长受破骨细胞和成骨细胞释放的信号调节。这些细胞之间经血管的有效联系对于维持骨骼稳态至关重要,外泌体便是介导这些细胞之间通过血液传递信息的重要载体。外泌体颗粒的直径范围从40到150纳米,含有丰富的生物活性分子,介导体内的细胞间通讯。除了生物学功能外,外泌体由于它们的结构优势而在纳米医学中表现出极大潜力,比如体积小、结构稳定、低毒性和生物相容性等。外泌体表面可以被肽、DNA纳米组件和纳米粒子进行修饰成为用于疾病诊疗的纳米平台,在药物输送、靶向治疗和生物成像等方面极具优势。骨髓间充质干细胞(BMSCs)、破骨细胞和成骨细胞分泌的外泌体已被证明参与骨稳态的调节。破骨细胞分泌的外泌体可以抑制成骨细胞活性并抑制成骨细胞介导的骨形成。成骨细胞和骨髓间充质干细胞分泌的外泌体能够增强成骨细胞的形成。然而,血管内皮细胞分泌的外泌体(endothelial cell-secreted exosomes,EC-Exos)是否在骨稳态中起调控作用仍然是未知的。
此外,血管生成对骨生成有调节作用。老年小鼠和卵巢切除小鼠的H型血管数量明显减少,并伴随有骨质疏松症。研究表明血管数量减少不仅与骨生成减少有关,而且还与骨吸收增加有关。内皮细胞(ECs)位于血管内层,属于摄取和分泌物质较为频繁的活化细胞类型。EC-Exos含有多种生物活性分子,参与细胞生长、迁移和血管发育调节。miRNA是长度约22个核苷酸的非编码RNA,在调节基因表达和调节许多生物过程中起重要作用。miR-155是脊椎动物特异性miRNA类型,可以调节血管新生和成骨分化。
在这项研究里,研究人员发现EC-Exos比成骨细胞衍生的外泌体或骨髓间充质干细胞衍生的外泌体更有效的骨靶向效果。EC-Exos可以被骨髓衍生的巨噬细胞(bone marrow-derived macrophages,BMM)内化并改变了BMM的形态。EC-Exos在体外抑制了破骨细胞活性并在卵巢切除的小鼠模型中抑制骨质疏松症。外泌体miRNA的测序结果显示miR-155在EC-Exos处理的BMM中高度表达。EC-Exos中的miR-155水平远高于BMM和EC中的miR-155水平,表明miR-155是EC来源囊泡的内源性物质。阻断BMM miR-155水平能够解除EC-Exos对破骨细胞的抑制,证实外泌体miR-155可能具有抗骨质疏松症的治疗潜力。该研究结果表明,EC-Exos可用作治疗骨吸收障碍的骨靶向、无毒纳米治疗药物。
参考文献:Song H, Li X, Zhao Z, Qian J, Wang Y, Cui J, Weng W, Cao L, Chen X, Hu Y, Su J. Reversal of Osteoporotic Activity by Endothelial Cell-Secreted Bone Targeting and Biocompatible Exosomes. Nano Lett. 2019 Apr 23. doi: 10.1021/acs.nanolett.9b00287.