肿瘤细胞的放疗抗性可能导致肿瘤的局部复发和远处转移复发,然而尚不清楚miRNA是否在放疗抗性或肿瘤预后中具有直接作用。近日,来自中国医学科学院北京协和医学院刘志华、惠周光、肖泽芬课题组的研究人员在Oncogene杂志上发表文章,他们发现miR-339-5p通过下调Cdc25A促进局部晚期食管鳞状细胞癌的放疗敏感性,并认为外泌体中的miR-339-5p可作为非侵入性生物标志物用于预测局部晚期食管鳞状细胞癌的放疗反应性。
食管癌是最致命的恶性肿瘤之一,5年总生存率(OS)低于20%。手术切除是食管癌患者的标准治疗方法,但对于T3和T4或淋巴结阳性患者来说,单纯手术治疗的效果不佳。新辅助放疗或放化疗(CRT)已成为局部晚期食管鳞状细胞癌(ESCC)的一种有前景的策略。大约25%的患者对化放疗高度敏感,可以实现病理完全缓解(pathologic complete response,pCR)。pCR在38.7%的II期ESCC患者和20%的III期ESCC患者中效果较好。然而,一些患者并未获得临床治疗效果,因为他们的肿瘤对放射治疗是无效的。如果没有事先了解患者是否对放射治疗敏感,就不可避免地出现有毒副作用的药物的过度治疗。因此,在治疗开始前获得有关放射治疗反应的更多信息将是十分必要的,这有助于将ESCC分为不同的类型,最终优化临床治疗选择。
微小RNA(miRNA)与特定靶mRNA的3'非翻译区结合,导致靶mRNA的翻译抑制或稳定性降低。值得注意的是,miRNA之前已被证明通过调节DNA损伤反应(DDR)对基因完整性和稳定性至关重要。肿瘤抑制性miRNA通过促进细胞凋亡和对治疗的敏感性进而降低了致瘤性,包括细胞生长和侵袭等。miR-205通过在乳腺癌中靶向ZEB1和Ubc13来抑制DNA损伤修复并增敏肿瘤细胞放疗反应。因此,miR-205的递送与放射疗法组合可能是癌症治疗的新策略。最近报道,几种miRNA与ESCC的治疗反应和临床结果相关。miR-192和miR-194的表达与局部晚期食管鳞状细胞癌的病理反应显著相关。这两种miRNA受p53的转录调控,并通过靶向调节G1/S和G2/M过程的许多转录因子诱导细胞周期停滞。
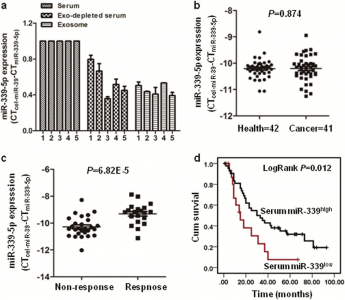
然而,miRNA是否可以调节放疗抗性并且用作ESCC中的肿瘤放疗增敏剂仍然不清楚。在这项研究中,研究人员发现miR-339-5p能促进放疗敏感性,并在食管癌细胞的放射抗性细胞亚群中下调。值得注意的是,miR-339-5p通过外泌体选择性地分泌到血液中,并且较高的血清miR-339-5p水平与放射治疗敏感性和良好存活率呈正相关。此外,与T1/ T2期ESCC患者相比,T3/T4期患者ESCC组织中miR-339-5p表达下调(P = 0.04),组织中低miR-339-5p表达表现为低总生存率(P = 0.036)和不良预后(P = 0.037)。miR-339-5p的过表达增强了体外和体内的ESCC细胞放疗敏感性。在机制上,miR-339-5p通过靶向Cdc25A增强放疗敏感性,而且这个过程受到Runx3转录调节。在组织样品中观察到miR-339-5p水平与Cdc25A/Runx3水平之间呈相关性。在TCGA数据库中,miR-339-5p与Runx3的组合分析比单独其中一个因子预测的生存期效果更佳(P = 0.009)。总之,外泌体来源的miR-339-5p通过下调Cdc25A介导放疗敏感性,并预测局部晚期食管鳞状细胞癌术前放疗反应性,这表明miR-339-5p可能是一种有前途的非侵入性生物标志物用于个性化治疗。
图:血清外泌体中的miR-339-5p可作为预测ESCC放疗敏感性及预后的生物标记物
参考文献:Aiping Luo, Xuantong Zhou, Xing Shi, Yahui Zhao, Yu Men, Xiao Chang, Hongyan Chen, Fang Ding, Yi Li, Dan Su, Zefen Xiao, Zhouguang Hui & Zhihua Liu. Exosome-derived miR-339-5p mediates radiosensitivity by targeting Cdc25A in locally advanced esophageal squamous cell carcinoma. Oncogene, 2019.