心肌来源的microRNAs在急性心肌梗死后会释放到体循环中,然而这些miRNA如何影响远端其他器官并不清楚。近日,来自华中科技大学同济医学院附属协和医院程敏课题组以及美国阿拉巴马大学伯明翰分校覃刚建课题组的研究人员在Nature communications杂志发表文章,发现心肌梗死后梗死部位会分泌外泌体miRNA到外周血中,并转移至骨髓单核细胞中促进祖细胞的动员,实现心血管细胞的修复。
祖细胞(progenitor cell,PC)或者其他干细胞从骨髓(bone marrow,BM)动员到缺血性心脏受损部位是一种生理性的修复反应。在过去的15年中,人们已经使用骨髓祖细胞进行了大量的细胞治疗临床试验,并证明了骨髓祖细胞对缺血性心肌损伤的有益修复作用。然而该修复效果比较一般,因此需要更加清晰的了解骨髓祖细胞的转运和招募机制,以开发更新和更有效的治疗策略。
微小RNA(miRNA)是体内具有生物活性的小非编码RNA,其与编码蛋白质的mRNA的3'非翻译区(3'UTR)中的互补序列相互作用,导致蛋白质翻译抑制或者mRNA降解。众所周知,一些miRNA是组织特异性表达的,例如,miR-208a和miR-499-5p在心脏组织中高度富集,而miR-1a和miR-133a在心脏和骨骼肌中均大量表达。这些在心肌丰度很高的miRNA(以下称为myo-miRNA)在患者和实验动物发生急性心肌梗死(acute myocardial infarction,AMI)后的外周血(peripheral blood,PB)中表现出高水平。然而,这些myo-miRNA如何在血液循环中运输以及它们的生物学意义仍然很大程度上是未知的。
外泌体是小的脂质双层囊泡,直径在50-150nm,可以由各种健康或不正常的细胞释放出来。越来越多的证据表明,外泌体介导细胞间遗传物质、DNA片段、mRNA和miRNA的交换和传递。然而,尚未探索外泌体的这些作用是否在对心脏缺血性损伤的全身反应中起作用。
在这项研究里,研究人员探索了循环myo-miRNA和外泌体在AMI模型小鼠中的作用。
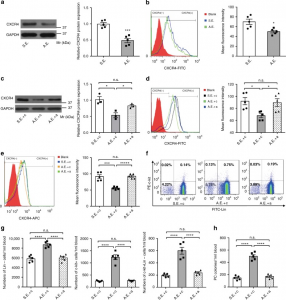
结果显示,循环myo-miRNA在外泌体中携带并介导缺血心脏组织和骨髓之间的功能性联系。在心脏发生损伤后,梗死部位的myo-miRNA迅速释放到外周血里,这些miRNA主要被包裹在外泌体中。在小鼠中,研究发现AMI伴随着循环myo-miRNA水平的增加,其中miR-1208和miR-499主要被包裹在循环外泌体中,而miR-133在非外泌体组分中。Myo-miR选择性地被外周器官所摄取,其中优先进入骨髓中。外泌体介导的myo-miRNA向骨髓单核细胞(mononuclear cells,MNC)的转移,其包裹的myo-miRNA下调CXCR4表达。将从AMI小鼠分离的外泌体注射到野生型小鼠中,会下调野生型小鼠骨髓单核细胞中的CXCR4表达并增加循环祖细胞的数量。因此,我们提出在循环外泌体中携带的myo-miRNA引起心脏缺血性损伤后的全身反应途径,其可用于缺损心脏组织修复。
图:外泌体myo-miRNA下调小鼠骨髓单核细胞中的CXCR4并诱导骨髓祖细胞的动员
参考文献:Cheng M, Yang J, Zhao X, Zhang E, Zeng Q, Yu Y, Yang L, Wu B, Yi G, Mao X, Huang K, Dong N, Xie M, Limdi NA, Prabhu SD, Zhang J, Qin G. Circulating myocardial microRNAs from infarcted hearts are carried in exosomes and mobilize bone marrow progenitor cells. Nat Commun. 2019 Feb 27;10(1):959.