在大多数肿瘤类型中都发现了B细胞相关的自身免疫应答,并且通过肿瘤相关抗原(tumor-associated antigens, TAAs)的自身抗体得到了证明。自身抗体的产生可能先于疾病症状,持续数月或数年。因此,循环中肿瘤相关自身抗体的检测或是癌症早期检测的可行方法。TAAs被免疫系统识别从而引发体液反应的过程没有得到很好地阐明。TAAs不仅包括携带突变的蛋白质,也包括结构上没有可辨别的改变的蛋白质。改变的定位或翻译后修饰也会引起自身抗体的产生。体液免疫应答在癌症中的功能意义尚不清楚,其改变肿瘤的发展或进展的证据仍不清晰。
外泌体是30-150 nm直径的细胞外囊泡(EVs),由特定的内体生物发生途径产生。外泌体具有多样化的分子组成,包括源自其起源细胞的蛋白质、RNA和DNA,并且可以防止在循环中被降解。EVs已成为细胞间通讯的媒介和潜在生物标志物。外泌体也在免疫反应中起重要作用。含有TAAs的肿瘤来源的外泌体可以将MHC-肽复合物以及整个抗原转移到树突细胞(DC)中,以加工和交叉呈递给肿瘤特异性T淋巴细胞。还有证据表明,肿瘤来源的外泌体可能对适应性和先天性抗肿瘤反应产生抑制作用。
通过对血浆来源的循环抗原-抗体复合物以及癌细胞系和血浆来源的外泌体的全面蛋白质组学分析,来自美国MD Anderson癌症中心的Samir M. Hanash教授团队研究了肿瘤相关外泌体对胰腺癌中自身抗体库的贡献。该研究发表在最新的Nature Communications杂志上,证明了肿瘤来源的外泌体与血浆中的循环免疫球蛋白结合,特别是肿瘤外泌体的膜表面具有作为自身抗体靶标的大量TAAs库。该研究提供了外泌体作为诱饵功能的证据,其减弱针对肿瘤细胞的补体介导的细胞毒性。
具体来说,该研究使用来自胰腺导管腺癌(PDAC)患者血浆的免疫球蛋白结合蛋白的深入蛋白质组学分析来研究与PDAC中的体液免疫应答相关的抗原库,并鉴定与外泌体标志蛋白一起诱导抗体应答的肿瘤抗原。PDAC细胞衍生的外泌体的分析揭示了它们的蛋白质成分与PDAC血浆中的免疫球蛋白结合蛋白的显著重叠,并且与健康对照相比,在PDAC细胞衍生的外泌体和患者血浆之间观察到显著的自身抗体反应性。重要的是,PDAC衍生的外泌体诱导PDAC血清介导的对癌细胞的补体依赖性细胞毒性的剂量依赖性抑制。总之,该研究提供了外泌体呈递大量肿瘤抗原的证据,外泌体肿瘤抗原诱导自身抗体并发挥针对补体介导的细胞毒性的诱饵功能。
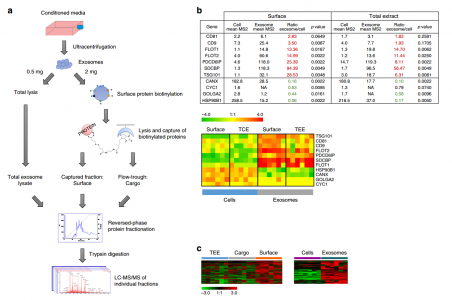
PDAC外泌体的蛋白质组学分析
与可溶形式的蛋白质相比,外泌体上的B细胞天然表位可能更有效地呈递并保护免于蛋白水解,使得它们更容易被B细胞接近,并导致协调的CD4+和CD8+ T细胞反应和自身抗体的分泌。
尽管如此,评估肿瘤外泌体负载DCs用于免疫刺激的试验已显示出有限的临床抗肿瘤效力,并且越来越多的数据表明肿瘤来源的EVs似乎确实具有免疫抑制作用。有大量证据表明肿瘤外泌体通过抑制T细胞和NK细胞的活化,促进髓源性抑制细胞的产生和增强T调节细胞功能来抑制抗原特异性和非特异性抗肿瘤反应。该研究提出肿瘤外泌体可能促进有利于免疫逃逸的B细胞反应。例如,外泌体可以促进免疫抑制性B细胞群的扩增。多项研究表明,肿瘤浸润B淋巴细胞通过具有免疫抑制功能的B细胞群增强肿瘤进展。此外,通过暴露几种TAAs,PDAC外泌体通过结合PDAC患者血清中存在的循环自身抗体而发挥广泛的诱饵样功能,从而抑制补体依赖性细胞毒性和潜在的抗体依赖性细胞介导的细胞毒性。与该研究结果一致,已有报道证明肿瘤来源的外泌体通过介导它们的隔离从而促进对细胞表面定向的抗CD20和抗Her2治疗性抗体的抗性,从而削弱针对癌细胞的特异性诱导的基于自身抗体的细胞毒性。这些观察结果提供了对由肿瘤衍生的外泌体介导的可能的免疫逃逸机制的新见解,这值得进一步研究并且可能解释基于外泌体的癌症免疫疗法的有限效果。然后可以靶向癌症外泌体以限制免疫抑制,潜在地增加当前疗法的功效。靶向肿瘤外泌体的方法也可能基于外泌体生物发生或分泌的小分子抑制。另一种方法是使用癌症特异性外泌体标记选择性地从循环中去除肿瘤外泌体,如,以亲和捕获肿瘤分泌的囊泡。
通过对PDAC细胞系外泌体蛋白质组、免疫球蛋白结合蛋白和癌症患者自身抗体反应性的综合分析,鉴定了许多外泌体表面相关的TAAs。其中许多是酶或细胞骨架蛋白(ANXA1,KRT10,KRT16,TUBB,ACTB,ACTA1,PKM2和HSPA8),之前已报道在不同肿瘤类型中(包括PDAC、乳腺癌、神经母细胞瘤)能够诱导产生具有诊断潜力的自身抗体。存在于免疫球蛋白结合部分中的几种PDAC细胞外泌体相关抗原(LGALSBP3,PKM2,HSPA8,KRT17,KRT16,ACTB,H2AF,KRT5和JUP)也显示PDAC患者血浆EVs相对于健康受试者的富集,提供了潜在的外泌体相关PDAC生物标志物的证据。
与匹配的对照相比,PDAC患者自身抗体显示出对整个肿瘤外泌体的更高的反应性。使用基于蛋白质微阵列的方法评估针对外泌体表面TAAs的自身抗体是否可能在PDAC中具有诊断价值。通过组合三个独立的血浆样品组,在早期PDAC患者中鉴定出与匹配的健康受试者和慢性胰腺炎对照组相比显著更高水平的针对两种外泌体表面蛋白(PKM2和LGALSBP3)的自身抗体。这些结果表明,外泌体TAAs的循环自身抗体提供了诊断效用并且值得进一步评估。
总之,该工作为肿瘤外泌体在调节免疫应答中的作用提供了新的见解,对PDAC治疗和早期检测具有重要意义,值得在PDAC和其他肿瘤类型中进一步探索。
参考文献:
Capello M, Vykoukal JV, Katayama H, Bantis LE, Wang H, Kundnani DL, Aguilar-Bonavides C, Aguilar M, Tripathi SC, Dhillon DS, Momin AA, Peters H, Katz MH, Alvarez H, Bernard V7, Ferri-Borgogno S, Brand R, Adler DG, Firpo MA, Mulvihill SJ, Molldrem JJ, Feng Z, Taguchi A, Maitra A, Hanash SM. Exosomes harbor B cell targets in pancreatic adenocarcinoma and exert decoy function against complement-mediated cytotoxicity. Nat Commun. 2019 Jan 16;10(1):254. doi: 10.1038/s41467-018-08109-6. 影响因子12.353