作者:企鹅
尽管在20世纪60年代后期首次描述了哺乳动物组织或体液中细胞周围存在囊泡,但直到2011年才提出通用术语“细胞外囊泡”(EVs)来定义所有脂质双层膜包裹的细胞外结构(图1)。如在20世纪80年代所述(图2),EV可以通过质膜的向外出芽或通过涉及晚期多泡内吞区室(多泡体,MVB)与质膜的融合的细胞内内吞运输途径形成(图2)。这种融合事件导致这些区室的腔内囊泡(ILV)的细胞外释放,产生称为“外泌体”的EV亚型,其具有与ILV相同的大小(直径<200 nm)。最初提出外泌体分泌作为细胞消除不必要蛋白质的机制。然而,20世纪90年代后期的工作表明它可以起到细胞间通讯的作用,特别是在免疫反应和癌症方面。对这一概念的强烈支持发生在2007年,当时外泌体被证明含有mRNA和微小RNA,当转移到受体细胞时,它们仍保持功能并改变靶细胞行为。同时,被称为微泡(microvesicles)、微粒(microparticles)或ectosomes的EVs可能从质膜释放,也被证明可以在细胞之间转移功能蛋白和RNA。已经观察到与外泌体或更大的大小相似的EV从主细胞体的质膜或各种细胞类型的膜发芽延伸,例如,微绒毛、丝状伪足、纤毛和鞭毛(图2)。外泌体大小范围内的EV在大小、密度和膜方向方面具有相同的生物物理特征(图1),因此,目前的方法无法有效地分离它们。关于细胞类型、环境条件和其他因素(例如,感染或分子的人工表达),MVB衍生的外泌体与其他小型EV的相对比例是高度可变的,并且通过大多数当前方案获得的样本可以包含内体(即外泌体)和非内体来源的小EV的混合物,以及其他基于脂质但非囊泡结构,如各种密度的脂蛋白(中、高、低或极低密度脂蛋白),以及新发现的外泌体(图1)。最近,富含晚期内体组分的外泌体被定义为带有四跨膜蛋白CD63(一种在MVB中积累的蛋白质)和CD9/CD81(主要在质膜上)的小型EV亚型,尽管该定义仍需其他细胞和条件的验证。
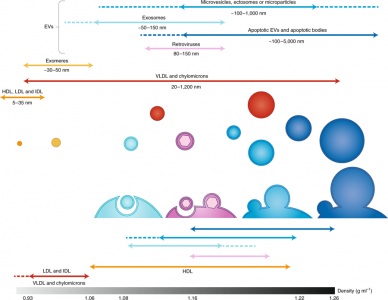
图1、不同EV亚型的物理特征。
这里将不同的EVs亚型与其它共分离的颗粒一起描绘,展示了这些EVs的亚细胞来源(内体或来自质膜)以及大小和密度范围。无论分泌机制如何,由于重叠的物理特性,不同的EV亚型不能根据大小或密度完全分离。例如,小微泡、外泌体和包膜病毒之间就不能完全分开。当细胞经历细胞凋亡时产生的细胞碎片,例如凋亡小体或小的凋亡小泡,可能与其他EV无法区分。可以与EV共分离的其他分泌颗粒包括外泌颗粒(exomeres)和不同类型的脂蛋白。在对含有这些囊泡的流体进行差速离心时,最大的(例如> 300 nm)以低速(约2,000g)和短时间(20-30分钟)离心回收,然后回收中等大小的EVs(150-300 nm),约10-20,000g,不到30分钟。最小的EV(<150 nm)主要在高速超速离心后获得,但这些样本可能包括最小的非EV成分(如,exomeres和高密度脂蛋白),特别是如果进行长时间离心。通过结合基于大小和密度的分离方法,可以将脂蛋白与EV分离。IDL:中密度脂蛋白;LDL:低密度脂蛋白;VLDL:极低密度脂蛋白。
在许多病理生理情况中,EV可发挥许多功能,包括参与癌症、免疫应答、心血管疾病、再生和基于干细胞的疗法。尽管许多研究将这些功能描述为外泌体特异性,但在许多外泌体制剂中发现的EV的潜在异质亚细胞来源表明多种EV类型的更广泛的功能相关性。这篇综述讨论了外泌体和质膜衍生的EV在生物发生和分泌、靶向和递送到受体细胞和随后的功能方面的特异性。
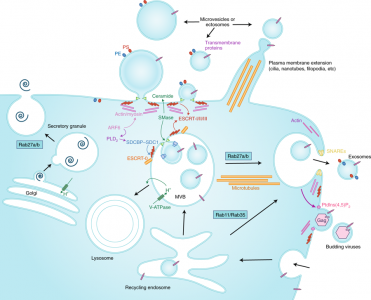
图2、EV分泌的机制
在质膜(微泡、微粒或ectosomes)或晚期内体MVB(外泌体)中EV生物发生和分泌的分子机制。Rab27a/b参与外泌体的MVB依赖性分泌,但也参与病毒和高尔基体衍生的分泌颗粒的释放。由SMAses和ESCRT产生的神经酰胺促进质膜和MVB内部的囊泡形成。两个位置的EV分泌需要ARF6和肌动蛋白细胞骨架的解聚。相比之下,磷脂酰乙醇胺(PE)和磷脂酰丝氨酸(PS)的外翻可能更具体地参与质膜衍生的EV分泌,而V-ATP酶介导的MVB酸化可能是外泌体分泌的特异性控制机制,尽管V-ATP酶抑制剂也可能影响高尔基体V-ATP酶。PLD2, phospholipase D2; PtdIns(4,5)P2, phosphatidylinositol-4,5-bisphosphate; SDC1, syndecan-1; SDCBP, syntenin-1。
该综述的主要内容包括:(1)囊泡在MVB内或质膜上出芽,其中介绍了ESCRT、脂质、Syndecan和syntenin、MVB酸化;(2)细胞内外泌体运输和EV分泌,这方面介绍了Rab GTPases、SNAREs、细胞骨架;(3)包膜病毒与外泌体和其他小型EVs的比较;(4)EV摄取的生物学及其功能的举例。
最后Thery也提出一些问题。尽管人们对这一领域的兴趣日益增加,但我们对控制EV生物发生、释放、摄取和功能的细胞和分子机制的理解仍然有限。精确表征EV的主要挑战是分离和表征特定亚型的技术难度,因为目前我们使用的方法无法完全区分不同亚细胞来源的EV。因此,尽管许多文章使用术语“外泌体”来指代通过物理过程与较大的EV分离的EV样本,但它们很可能是指外泌体和非外泌体性质的小EV的混合物。因此,除非他们的MVB起源已经明确建立,否则最好使用通用术语“小型EV”。
为了使EV领域取得进展,有必要以综合的方式进行研究,包括分子、细胞和功能表征,并尽可能地比较给定实验系统中的不同EV亚型。这些方法对于确定不用EV亚型的不同分子或机制是至关重要的。
目前尚未就EVs或给定EV亚型在受体细胞的胞质溶胶中递送内容物的主要途径达成共识。确定是否通过巨胞饮作用或微胞饮作用和/或受体介导的途径发生内化,以及这些过程是否导致货物递送对于理解和控制EV摄取是必不可少的。或可通过跟踪存在于许多不同EV类型中的通用可溶性成分,以确定物质交换具有显著生理和生化作用的条件。然后,该知识将允许表征EV摄取和内容物递送的细胞和分子基础。考虑各种生物发生、释放和摄取途径如何影响与EV无关的细胞内功能也很重要。这样的系统分析将有助于在生理和病理环境中识别特定EV功能,并且将有助于转化该知识以用于治疗EV的病理效应或EV相关细胞机制的治疗应用。
参考文献:
Mathieu M, Martin-Jaular L, Lavieu G, Théry C. Specificities of secretion and uptake of exosomes and other extracellular vesicles for cell-to-cell communication. Nat Cell Biol. 2019 Jan;21(1):9-17. doi: 10.1038/s41556-018-0250-9. Epub 2019 Jan 2.
外泌体资讯网 【NCB】Théry大牛的最新细胞外囊泡综述