作者:企鹅
简要:外泌体是新一代的药物递送载体。伦敦国王学院的研究人员建立了一种具有高产率和纯度的用于siRNA递送的外泌体分离方案。该方案还将荧光标记的非特异性siRNA包装到外泌体中,并研究了癌细胞对携带siRNA的外泌体的摄取。
外泌体是细胞外囊泡(EV)的亚型,直径范围为50-200 nm,由各种细胞类型如免疫细胞、癌细胞和干细胞分泌。外泌体也存在于各种生理液体中。外泌体携带各种生物分子(例如RNA和蛋白质)的固有能力和这些生物分子有效递送到受体细胞中的组合引起了对它们作为纳米级药物递送载体的潜力的兴趣。已经证明,用作抗癌和抗炎药物的各种小分子成功地加载到外泌体中并递送至靶细胞。诸如siRNA和microRNA的核酸也已通过电穿孔成功地加载到外泌体中并递送至靶细胞。
最近,通过小干扰RNA(siRNA)的RNA干扰(RNAi)由于其高特异性、有效效应、最小副作用和易于合成而作为基因沉默的优选机制获得了更多的关注。siRNA是长度为19至25个核苷酸的双链RNA分子,其触发序列特异性催化mRNA敲低。由于其分子量大、聚阴离子性质,裸siRNA被动摄取到细胞中受到阻碍。由于血浆核酸酶的快速降解,裸siRNA也不可能注入体循环。因此,siRNA在纳米载体中的包封将有助于siRNA有效递送和摄取到靶细胞中。
外泌体是siRNA包封的理想系统,因为其结构由被磷脂双层包裹的中空含水核心组成。外泌体不仅在血液中具有良好的稳定性,而且还具有天然靶向特性以将功能性RNA递送至细胞中。Alvarez-Erviti等成功地证明了使用工程化外泌体有效地将siRNA递送到小鼠的大脑,几乎没有并发症。基于外泌体的疗法比其他疗法相对安全,因为外泌体不像细胞那样内源性地复制,因此不表现出转移性质。
已经报道了各种方法成功地从细胞培养物或生理液体中分离外泌体。最流行的方法是使用超速离心从起始材料中沉淀外泌体。该方法比较粗糙,并且通常从样品中共沉淀蛋白质。将超速离心与基于密度的分离(例如蔗糖梯度)相结合变得越来越普遍,以减少分离的外泌体中的蛋白质和非外泌体污染。尺寸排阻色谱(SEC)通过大小分离外泌体与其他类型的细胞外囊泡(EV),并且还可以达到最小的蛋白质污染,但是受到可以处理的起始材料量少的限制。免疫亲和捕获使用涂有抗体的珠子,抗体结合外泌体表面蛋白质如四跨膜蛋白或其他细胞特异性标记物,允许特异性捕获外泌体而不是EV或其它蛋白质,以及从整个样品中分离外泌体的亚群,但是同样受原料量的限制并且成本高。基于聚合物的外泌体沉淀过去也很受欢迎,但由于它是一种相当粗糙的沉淀,它会导致更高的非外泌体囊泡和蛋白质污染。
据报道,由于蛋白质聚集,电穿孔作为用siRNA加载外泌体的方法效率低。基于转染的方法被证明具有更好的加载效率和蛋白质稳定性,但由于其毒性和转染剂在改变细胞基因表达中的副作用而受到限制。因此,电穿孔已经更广泛地用于siRNA加载到外泌体中,因为它是更安全的方法。然而,需要建立优化的包装方法以将足够量的siRNA递送至靶位点以进行有效的基因敲低。
这篇报道提出了一种外泌体分离方案,该方案使用基于密度的超速离心法,在仅用重水制备的25%(w/w)蔗糖垫上,而不是蔗糖密度梯度。这是一种经济有效的方法,可以避免繁琐的密度梯度制备并允许处理大量的起始材料,但产生高产率和纯度的完整外泌体,适合随后用siRNA加载。通过电穿孔将荧光Atto655-缀合的非特异性siRNA加载到HEK-293细胞衍生的外泌体中,并在体外递送至人胰腺癌(PANC-1)癌细胞。
PROTOCOL
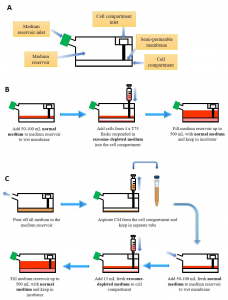
图1:用于外泌体生产的生物反应器中细胞的培养。(A)生物反应器烧瓶的简化解剖结构。(B)在生物反应器烧瓶中开始培养。关于正常和外泌体去除的培养基的组成,(C)收获条件培养基(CM)并在生物反应器中维持培养物。
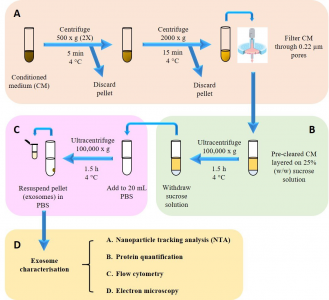
图2:外泌体的分离和表征。(A)去除死细胞和细胞碎片,收集条件培养基(CM)。(B)将外泌体从CM分离到蔗糖垫上。(C)洗涤步骤以除去蔗糖和污染蛋白质。(D)然后对分离的外泌体进行物理化学、生物化学和形态学表征。
通过蔗糖垫超速离心法得到外泌体后,通过电穿孔将siRNA包装到外泌体中
- 在电穿孔前将电穿孔比色皿预冷却30分钟。
- 在微量离心管中混合0μg外泌体(32 µL from 7 x 1012 p/mL stock in PBS)和0.33μg siRNA(12 µL from 2 µM stock in RNase-free water)。用柠檬酸缓冲液将体积补足至150μL。在这种情况下,外泌体与siRNA的摩尔比为1:60。
- 将混合物转移到电穿孔杯中。盖上比色杯并将其放入电穿孔仪的比色皿支架中。顺时针旋转转轮180°。注意:必须完全转到锁定位置,以便比色皿接触电极。
- 选择所需的电穿孔程序(例如,X-01,X-05,A-20,T-20,T-30等),然后按开始按钮开始电穿孔。注意:显示屏上显示“OK”表示成功的脉冲。
- 完成后,逆时针旋转车轮180°后取下比色杯。用塑料移液管从比色杯中取出样品进行进一步处理。
使用尺寸排阻色谱法(SEC)去除游离siRNA。
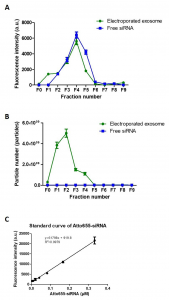
图4、电穿孔后的外泌体纯化。(A)使用尺寸排阻色谱法测定Atto655-siRNA和电穿孔外泌体的洗脱曲线(F0-F9)。(B)使用尺寸排阻色谱法对Atto655-siRNA和来自F0至F9的外泌体进行NTA分析。(C)Atto655标记的siRNA的校准曲线。通过平板读数器在Ex/Em:640-10/680nm处获得荧光强度;增益2800。数值表示为平均值±SD(n=3)
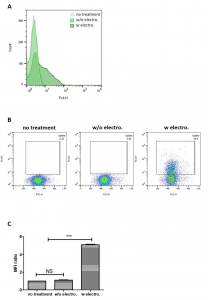
图5、siRNA包封的外泌体处理4小时后,PANC-1细胞细胞的摄取。(A)比较未负载的外泌体+siRNA混合物和siRNA包封的外泌体的细胞摄取的直方图。(B)通过伪彩色图在4小时摄取未负载的外泌体+siRNA混合物的比较。(C)与未处理细胞相比,测试样品的平均荧光强度(MFI)值的倍数差异。值表示为平均值±SD,其中n=3. *** P<0.001。
详细protocol请至论坛(www.exosome.com.cn)同名贴下下载原文PDF。
参考文献:
Faruqu FN, Xu L, Al-Jamal KT. Preparation of Exosomes for siRNA Delivery to Cancer Cells. J Vis Exp. 2018 Dec 5;(142). doi: 10.3791/58814.