作者:企鹅
外泌体是纳米尺寸(40-150 nm)的细胞外囊泡,具有脂质双层膜,被大多数细胞类型释放,是细胞间通讯系统的一部分,携带RNA和蛋白质。通过外泌体转移的信息影响受体细胞的表型。干细胞衍生的外泌体介导细胞恢复功能并调节炎症状态。由于其独特的运输特征,外泌体正在被探索作为治疗性RNA递送载体。
外泌体技术作为递送平台的临床前和临床开发需要大量的外泌体。外泌体的分离方法需要易于扩展以支持大规模生产。目前的方法产量低并且不可扩展,这阻碍了外泌体在临床前动物中功效评估。通常每只小鼠使用的剂量为109-1011,以实现生物学结果。分离这种外泌体量需要处理一升的条件培养基来处理一只动物。因此,顺利支持动物研究的外泌体生产可能需要数月时间。外泌体通常通过分子大小排阻或亲和层析,或通过密度梯度或差异超速离心(UC)来纯化。外泌体差速离心回收的金标准需要四到五个连续的离心步骤。这些方法都不可扩展。与永生肿瘤细胞系不同,间充质干细胞(MSC)的扩增能力是有限的。外泌体的低产量阻碍了间充质干细胞用于外泌体的大规模生产。
来自马萨诸塞大学医学院的研究人员结合了两种生产策略的优势,开发了一种强大且可扩展的策略,与间充质干细胞产生外泌体的GMP兼容:(1)基于微载体的三维(3D)细胞培养,通常用于生物反应器中的贴壁细胞培养;(2)切向流过滤(tangential flow filtration, TFF),一种从大量细胞培养基中浓缩蛋白质或病毒的方法。
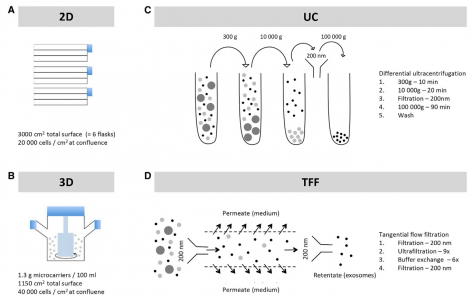
间充质干细胞培养方法和外泌体分离方法的方案 (A)基于flask(二维)间充质干细胞培养的示意图。将细胞在间充质基础培养基中培养至密度为20,000个细胞/cm2。(B)基于微载体(三维)间充质干细胞培养的示意图。将细胞在250-mL旋转瓶中的无血清/GMP相容培养基中的微载体上培养至~40,000个细胞/cm2。(C)通过差异超速离心分离外泌体。通过连续超速离心、过滤和洗涤步骤从培养上清液中富集外泌体。(D)通过切向流过滤分离外泌体。使用500 kDa截留柱通过切向流过滤从培养上清液中富集外泌体。
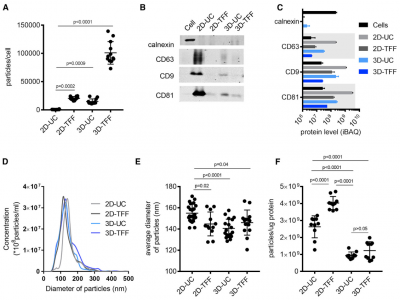
该研究比较了来自2D或3D培养物的外泌体的物理化学特征,以及由差异UC或TFF产生的外泌体的物理化学特征。结果表明,3D培养结合TFF可将外泌体的产量提高140倍。这些外泌体在将治疗性小干扰RNA(siRNA)转移至原代神经元的能力上具有7倍的活性。因此,这里报道的方法提高了间充质干细胞外泌体的产量,并使其能够进行临床前探索。
2D与3D,超离与切向流过滤,4种方法提取的外泌体的特征分析
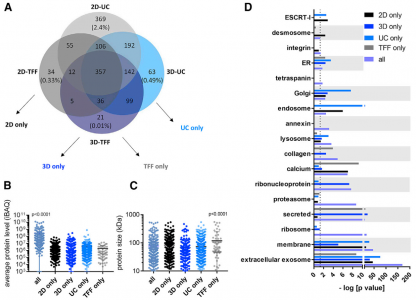
外泌体作为治疗递送载体的开发需要与GMP相容的生产和纯化方法。3D培养系统、xenofree培养基和TFF适用于GMP级生物制剂。该研究显示脐带间充质干细胞的3D xenofree培养物和条件上清液TFF产生的外泌体产量显著高于标准2D培养和超速离心。通过UC和TFF从2D和3D培养物中分离的外泌体具有相似的大小分布和蛋白质含量,3D-TFF-外泌体在向神经元递送siRNA和诱导mRNA沉默方面更有效。
蛋白质与囊泡比率的差异以及外泌体样本之间的活性差异可能反映了它们的产生和制备方法的差异。3D-外泌体制剂中的高蛋白质与囊泡比率可能是由在用于3D培养的GMP兼容的xenofree培养基中形成的蛋白质聚集体产生的。毫无疑问,需要优化xenofree培养和纯化条件以鉴定和产生具有所需蛋白质含量和蛋白质与囊泡比率的外泌体。细胞培养方法和外泌体分离方法均有助于改善3D-TFF-外泌体的siRNA转移和基因沉默活性。来自3D和2D培养细胞的外泌体之间细胞摄取的差异可以通过蛋白质含量的差异来解释:3D外泌体中一些分泌蛋白(例如AHSG和白蛋白)的富集可以增强内吞作用,核糖核蛋白的富集可以在摄取时导致更有效的细胞内途径。施加于外泌体的离心力可能损害外泌体膜的完整性并损害细胞摄取。因此,与2D-UC-外泌体相比,没有与UC相关的破坏作用也可能有助于提高3D-TFF-外泌体的性能。
4种方法提取的外泌体蛋白分析
脐带是干细胞的丰富来源。一条人的脐带可以产生估计数量为1000万的华通氏胶(Wharton’s jelly)来源的间充质干细胞。传至第6代,使用3D培养和TFF可生产为6×1013个外泌体。对于临床前小动物研究,每只小鼠用109-1011个外泌体进行计算,一条脐带可以提供足够的外泌体来治疗600-60,000只小鼠。因此,大规模动物研究可能由来自单个脐带分离的低代数(6代以下)间充质干细胞的外泌体来生产。
开发细胞培养条件和外泌体分离方法以推进外泌体技术。治疗性病毒的产生可以作为外泌体技术开发的一个例子。虽然我们使用脐带来源的间充质干细胞,但这里描述的细胞培养和外泌体分离方法应该适用于其他细胞来源。需要根据已发表的小规模外泌体分离方法的建议,详细制定大规模外泌体生产的质量控制步骤。蛋白质与外泌体的比例应被视为质量控制方案的一部分。
遗传干扰策略正在发展成为治疗遗传性疾病的有希望的治疗药物。该研究使用亨廷顿蛋白(Huntingtin)siRNA的传递和沉默作为大规模产生的外泌体活性的指标。该研究推测通过TFF从基于微载体的3D xenofree培养物产生的外泌体将被证明可用作针对多种疾病的其他治疗性寡核苷酸(siRNA、反义寡核苷酸和CRISPR guide RNA)的递送载体。这里描述的有效、可扩展的外泌体分离方法将有助于外泌体技术向临床应用转化。
参考文献:
Haraszti RA, Miller R, Stoppato M, Sere YY, Coles A, Didiot MC, Wollacott R, Sapp E, Dubuke ML, Li X, Shaffer SA, DiFiglia M, Wang Y, Aronin N, Khvorova A. Exosomes Produced from 3D Cultures of MSCs by Tangential Flow Filtration Show Higher Yield and Improved Activity. Mol Ther. 2018 Sep 22. pii: S1525-0016(18)30456-8. doi: 10.1016/j.ymthe.2018.09.015. [Epub ahead of print]PMID: 30341012
外泌体资讯网 如何大规模生产间充质干细胞外泌体?