作者:企鹅
Ⅰ型糖尿病(T1D)是一种自身免疫疾病,其特征在于免疫细胞对胰岛的浸润和选择性消除分泌胰岛素的β细胞。研究人员已经在非肥胖糖尿病(NOD)小鼠(一种众所周知的T1D模型)中观察到免疫细胞的浸润,而且也在人类糖尿病供体的胰岛中观察到。T1D患者需要终身服用胰岛素以调节全身葡萄糖代谢和体内平衡。了解胰腺β细胞和浸润性免疫细胞之间的交流对于促进设计新的策略以预防该疾病的发展和/或寻找治愈方法至关重要。
已知免疫细胞对β细胞存活的有害作用部分是通过释放促炎细胞因子来实现的。然而,最近发现淋巴细胞释放另一类免疫介质:外泌体。外泌体是直径为50-150 nm的小细胞外囊泡,其起源于晚期内体途径,多泡体与质膜融合后释放到细胞外空间。外泌体由许多细胞类型释放,包括淋巴细胞和胰岛,并存在于血液和其他体液中。这些细胞外囊泡转运蛋白质、mRNA和非编码RNA,可以以活性形式转移到受体细胞,这表明细胞间通讯具有重要作用。之前,大多数关于外泌体的研究都是在体外或离体细胞模型中进行的,体内研究现在越来越多。例如,在小鼠中使用Cre-loxP系统或人特异性微小RNA(miRNA)证明了外泌体成分在细胞之间的远距离传递。有趣的是,有研究发现外泌体对核酸的转移是由炎性条件促进的。
miRNA构成外泌体运输的主要货物之一。这些小的非编码RNA是基因表达的关键转录后调节剂,并且可以通过外泌体以活性形式转移至受体细胞。miRNAs在β细胞活性的控制中起重要作用。实际上,miRNAs参与β细胞的分化和功能成熟并调节胰岛素分泌和细胞存活。miRNA表达的失调与T1D和T2D的发展以及与β细胞增殖的年龄相关的下降有关。此外,发现一些miRNA在啮齿动物和人胰岛中在炎性条件下诱导β细胞功能障碍和死亡。
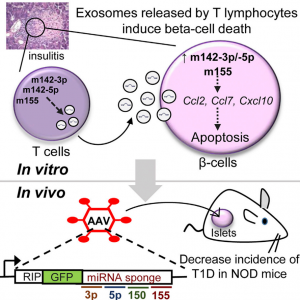
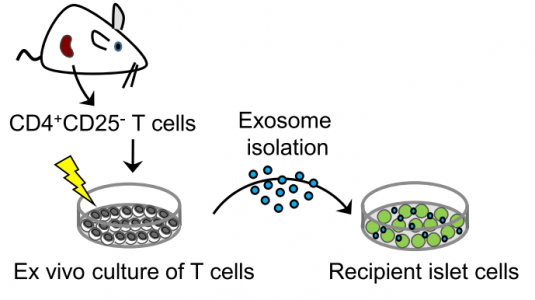
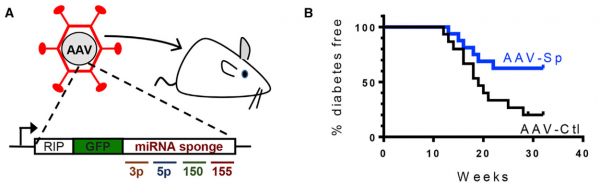
来自瑞士洛桑大学的Romano Regazzi课题组在最新一期的Cell Metabolism杂志上报道了淋巴细胞外泌体miRNAs参与NOD小鼠T1D发育初始阶段的研究。研究发现胰岛炎与外泌体介导的特定miRNAs组转移有关,即miR-142-3p、miR-142-5p和miR-155,从淋巴细胞到β细胞,导致胰岛素分泌细胞选择性死亡。在体外,β细胞内这些miRNA的失活保护它们免受T淋巴细胞外泌体诱导的细胞凋亡,并在体内阻止NOD小鼠中的T1D发展。来自受保护的NOD小鼠的胰岛显示出更高的胰岛素水平,更低的胰岛炎评分和减少的炎症。观察外泌体作用的机制,发现T淋巴细胞外泌体仅在β细胞中触发细胞凋亡和参与趋化因子信号传导的基因表达,包括Ccl2、Ccl7和Cxcl10。这些基因的诱导可能促进免疫细胞的募集并在自身免疫攻击期间加剧β细胞死亡。总之,该研究结果表明由淋巴细胞释放的外泌体介导的miRNAs的转移破坏β细胞,并且可能是导致T1D发展的机制的一部分。这些数据指出外泌体-miRNAs转移作为免疫细胞和胰岛素分泌细胞之间的通信模式。
要点:
- T淋巴细胞释放含有特定microRNAs的外泌体
- T淋巴细胞外泌体可以将microRNAs转移到啮齿动物和人胰腺β细胞
- 转移的microRNAs触发β细胞的趋化因子表达和凋亡
- 抑制β细胞中转移的microRNAs会降低NOD小鼠的糖尿病发病率
该研究关注从CD4+ T效应细胞转移到β细胞的miRNAs。然而,浸润胰岛的其他免疫细胞释放具有相似miRNA成分的外泌体。例如,miR-150和miR-155分别在源自单核细胞和巨噬细胞的外泌体中释放,并且对受体细胞具有功能性影响。免疫浸润的组成和外泌体的来源可能随着疾病的进展而不同。该研究的数据不排除其他免疫细胞在β细胞功能障碍和丢失中渗入胰岛产生的外泌体的贡献。在T1D发育期间miRNAs向β细胞的转移主要通过侵入胰岛的活化免疫细胞的紧密接近来促进。然而,外泌体成分的量和组成根据免疫细胞的活化状态而变化。实际上,据报道活性T细胞释放的外泌体含有更高水平的miR-142-3p。在体内,有可能在浸润性免疫细胞的外泌体表面存在自身反应性T细胞受体或其他特定组分可促进与β细胞的融合和miRNAs的递送。此外,免疫细胞释放的外泌体可携带可能影响靶细胞活性的其他分子,包括其他RNA、蛋白质和脂质。更好地理解控制外泌体和它们所提供的货物的靶向机制不仅有助于阐明触发T1D的机制,而且还可以揭示其他自身免疫疾病的病因学。
该研究研究结果对于设计更好的预防T1D发展方法具有相关意义。避免β细胞丢失的策略需要考虑这种新发现的细胞间信号传导机制的存在。外泌体介导的miRNAs转移对β细胞的有害作用可能加剧了入侵免疫细胞释放的促炎细胞因子的有害影响,并且很可能与参与自身免疫反应的其他充分描述的事件协同作用。因此,解决免疫攻击的几个方面的治疗性干预可能在保护β细胞方面更有效。
再好的研究也有其局限性:
这项研究发现阻断从淋巴细胞转移到β细胞的一组miRNAs活性的AAV病毒降低了NOD小鼠中T1D的发生率。尽管这些小鼠构成了广泛使用的T1D模型,并与人类该疾病的许多特征相似,但还需要进一步的研究来评估我们的研究结果的转化潜力。事实上,人类T1D的特征在于胰岛内浸润不太明显,并且发现在NOD小鼠中预防该疾病的几种免疫疗法在人类中效果不佳。未来的实验还必须研究在疾病的不同阶段治疗的功效。实际上,在该研究中,在自身免疫反应开始之前注射miRNA海绵,并且我们忽略了在胰岛内浸润发生后治疗是否同样有效。这些信息对于评估基于本研究发现的人T1D治疗潜力是必不可少的。
参考文献:
Guay C, Kruit J K, Rome S, et al. Lymphocyte-Derived Exosomal MicroRNAs Promote Pancreatic β Cell Death and May Contribute to Type 1 Diabetes Development[J]. Cell Metabolism, 2018. DOI: 10.1016/j.cmet.2018.09.011