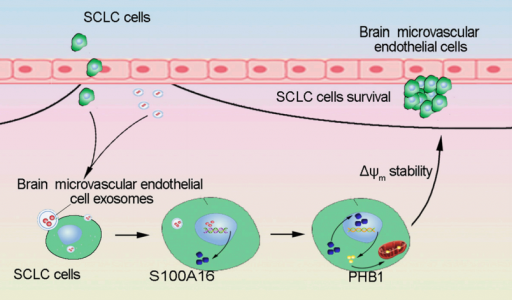
小细胞肺癌(SCLC)是肺癌最具侵袭性的组织学亚型,容易引起早期脑转移。尽管SCLC新疗法正在进步,SCLC伴随脑转移患者的预后仍然很差。近日,来自中国医科大学的研究人员在FASEB J杂志中提供证据表明外泌体在SCLC脑转移中的作用。由脑微血管内皮细胞衍生的外泌体介导的S100A16高表达赋予了SCLC的脑转移过程。
小细胞肺癌(SCLC)是在所有肺癌种类中最具侵袭性的恶性肿瘤类型,表现出强烈的增殖能力和早期转移能力。脑是SCLC转移最常见的部位,高达50-80%的SCLC病例都有转移到大脑的情况,这是导致大多数SCLC相关死亡的原因。并且,超过30%的脑转移都来自SCLC。虽然在SCLC管控方面取得了很多进展,但SCLC脑转移患者的预后一直很差。因此,了解SCLC相关脑转移的细胞和分子机制对于开发有效的治疗选择是必要的。
与其他器官相比,脑中的微血管内皮细胞形成了紧密的物理血脑屏障(BBB),以防止物质在血液和脑间质液之间交换。因此,BBB的存在是肿瘤细胞突破的障碍。然而,SCLC表现出明显的器官特异性和转移趋向性,并且通常在诊断前已经转移到大脑。因此,必须有独特的机制来解释SCLC脑转移的器官趋向性。越来越多的研究揭示了NSCLC向大脑转移的分子生物学机制,NSCLC相关特征和表面标志物可指导器官特异性转移。例如,CD44和趋化因子受体-4在NSCLC细胞表面上的表达被认为有助于肺癌细胞向脑细胞转移。据报道,基质金属蛋白酶9(MMP9)在源自肺腺癌的脑转移灶中特异性过表达,这表明MMP9在肿瘤细胞穿过血管系统向脑实质中的迁移中具有重要作用。此外,一系列研究发现了许多NSCLC脑转移中的生长因子。虽然SCLC的独特之处在于它具有很高的脑转移倾向,但对SCLC脑转移的关注却比较有限。一项临床研究表明趋化因子受体-4的高表达可能与SCLC脑转移相关,并且脑转移中存在Disheveled-1、Disheveled-3、E-cadherin和β-Catenin的异常表达,这表明Wnt信号在SCLC脑转移中的重要性。研究人员之前的研究揭示了在SCLC细胞迁移穿过BBB期间,RLC/Rho相关蛋白激酶信号通路在人脑微血管内皮细胞(HBMECs)中的作用。此外,SCLC细胞可能释放PIGF以增加BBB通透性,从而促进脑转移。此外, HBMEC条件培养基培养下的SCLC细胞的粘附和跨内皮迁移增加归因于源自SCLC细胞的膜联蛋白A1的自分泌信号传导。这些数据表明,SCLC细胞与相关的脑微血管内皮细胞之间的相互作用可能促进SCLC细胞获得跨内皮迁移的能力。肿瘤细胞的脑特异性转移不仅取决于脑微血管内皮细胞之间紧密连接的选择性开放,还取决于脑实质中肿瘤细胞的存活力。目前,脑微血管系统在肿瘤微环境中对脑内SCLC转移性定植和生长的潜在机理仍然知之甚少。
在之前的研究中,研究人员建立了一个涉及细胞共培养系统的体外模型,以探索SCLC细胞是否对来自脑微血管内皮细胞的信号起反应,或来自肿瘤细胞影响微血管内皮细胞的改变。与脑内皮细胞共培养的SCLC细胞的基因表达谱显示,S100家族的成员S100A16和膜联蛋白家族显著上调。因此,研究人员推测S100A16与SCLC恶性肿瘤有关,尤其是脑转移过程中。在食管中检测到S100A16的高表达,在肺和脑中是低表达。 S100A16在每个特定组织中的生理功能尚不完全清楚。据报道,S100A16在各种肿瘤中上调。 S100A16和S100A14的共表达与乳腺癌患者的预后不良有关。这些蛋白质相互作用可通过与细胞骨架动力学的相互作用促进乳腺癌细胞的侵袭活性。此外,S100A16的上调通过乳腺癌细胞系MCF-7中的Notch1途径促进上皮间质转化。相反,口腔鳞状细胞癌标本中S100A16表达的下调与预后不良和低分化程度相关。S100A16于口腔鳞状细胞癌中不具侵袭性的肿瘤表型相关。这些发现暗示S100A16在肿瘤发展和进展中起着不同的作用,这取决于癌症的病理类型。在肺癌中,两项研究得出结论,S100A16是一种有希望的生物标记物,肺腺癌铂类辅助化疗有效性的预后标志物。然而, S100A16的病理作用,特别是SCLC脑转移中,至今尚未见报道。
在这项研究中,研究人员使用体外细胞共培养系统发现,SCLC细胞与HBMECs的共培养导致SCLC细胞中S100A16的表达增加。相反,用外泌体释放抑制剂GW4869处理HBMEC显著阻断了共培养的SCLC细胞中的这种作用。Western印迹分析和免疫荧光的结果表明,通过超速离心纯化的HBMEC外泌体也诱导受体SCLC细胞中S100A16的升高以及从细胞质到细胞核的易位。抑制实验表明,升高的S100A16有助于HBMEC外泌体对应激下受体SCLC细胞的存活。此外,SCLC细胞中S100A16的升高阻止了线粒体膜电位的损失,在应激条件下细胞凋亡抵抗性增强。进一步的结果表明,S100A16介导的保护作用是由线粒体膜电位中的重要元素,即线粒体内膜中的蛋白质抑制素-1(PHB-1)引起的。研究结果表明,升高的S100A16通过调节线粒体功能在促进SCLC细胞存活中发挥积极作用, S100A16可认为是SCLC脑转移的重要潜在靶点。
参考文献:Xu ZH, Miao ZW, Jiang QZ, Gan DX, Wei XG, Xue XZ, Li JQ, Zheng F, Qin XX, Fang WG, Chen YH, Li B. Brain microvascular endothelial cell exosome-mediated S100A16 up-regulation confers small-cell lung cancer cell survival in brain. FASEB J. 2018 Sep 5:fj201800428R.