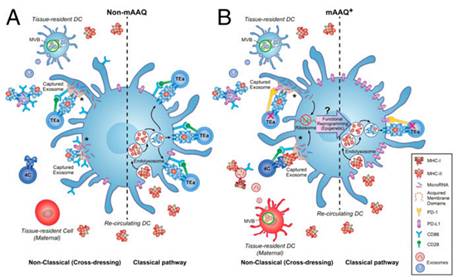
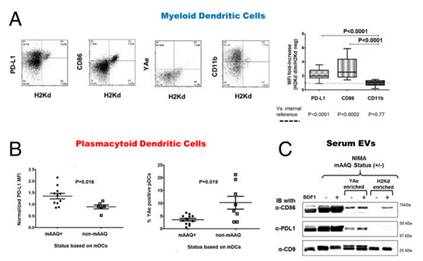
已经发现母体微嵌合(MMc)与异体移植耐受、抗肿瘤免疫和跨代生殖适合度相关联,但其作用方式仍是未知的。威斯康辛大学麦迪逊分校的研究人员发现在鼠模型中,MMc在所有后代中导致暴露于非遗传的母体抗原,但是在一些情况下,MMc量级足以引起宿主树突细胞(DC)的膜同种异体抗原识别(mAAQ; “cross-dressing”)。来自mAAQ +,但不是来自非mAAQ的小鼠的富含胞外囊泡(EV)的血清在体外再现DC反串现象。在体内,mAAQ与骨髓DC(mDC)的免疫调节剂PD-L1和CD86的表达增加以及同种异体肽+自身MHC复合物的表达减少以及浆细胞样DC(pDC)的PD-L1增加相关。值得注意的是,含有获得的MHC同种抗原的血清EV富集部分和膜微结构域,包括CD86,但完全没有PD-L1。相比之下,含有allopeptide+自身MHC的EV的部分和微结构域不排除PD-L1。外源特异性转基因CD4 T细胞的适应转移揭示了mAAQ+小鼠中的“分裂耐受性”状态:识别完整获得的MHC同种异体抗原的T细胞增殖,而响应于allopeptide+自身MHC的T细胞没有增殖。使用分离的pDC和mDC用于与allopeptide+自身MHC特异性CD4 T细胞的体外培养,可以在非mAAQ小鼠中复制它们的正常激活,并且在mAAQ+宿主中复制PD-L1依赖性失效。 总之,EV提供微嵌合和分裂耐受之间的生理相关性,涉及肿瘤免疫、移植、自身免疫和生殖成功率。
重要性
在移植和自身免疫领域中,耐受性的诱导仍然是一个理想,并且很大程度上未实现的目标。了解自然异质耐力机制有助于实现这一目标。这项研究发现母亲微嵌合体产生“分裂”耐受,刺激经典同种异体反应性(即,通过CD4 T细胞识别完整肽/同种异型MHC II类复合物),同时沉默CD4 T细胞响应自体MHC中的肽。这些相反的活动可以归因于在单个宿主树突细胞的表面上存在具有不同共刺激特性的单独的抗原微结构域。这种状态是从微嵌合体来源的胞外囊泡的相互作用发展而来,可能对细胞生物学、癌症免疫治疗和分子免疫学有重要的影响。
树突状细胞的表型分析和细胞外膜泡的PD-L1和CD86的成分分析
参考文献:Bracamonte-Baran, W., et al. (2017). "Modification of host dendritic cells by microchimerism-derived extracellular vesicles generates split tolerance." Proc Natl Acad Sci U S A. IF=9.423
版权归外泌体之家所有,欢迎转载,但请注明出处和原文链接!
原文下载和讨论请点击:http://www.exosome.com.cn/thread-1384-1-1.html?_dsign=ed05347e