纤毛(cilium)是一种细胞表面比细胞小5000倍的小仓室,集中了Hedgehog信号传导、视觉、嗅觉和体重稳态的受体。通过维持其自身的第二信使环状AMP(cAMP)和Ca2+的浓度,纤毛为信号分子提供了独特的反应条件,这些信号分子在通路激活时动态进入和离开纤毛。例如,Hedgehog通路的激活触发G蛋白偶联受体(GPCR)GPR161的纤毛出口(ciliary exit),导致的纤毛体cAMP水平的降低促进随后的信号传导步骤。信号依赖性纤毛出口可以延伸到一些光转导分子和GPCR生长抑素受体3(SSTR3)和神经肽Y受体2(NPY2R)。然而,这种纤毛出口对信号转导的功能重要性仍然比较有争议。
用于将活化的GPCR从纤毛回收回细胞的常规途径依赖于构象传感器β-arrestin 2和BBSome(一种巴尔得-别德尔综合征 <Bardet-Biedl Syndrome> 蛋白复合体,其与Arf样的GTP酶会形成膜包被复合体Arl6/Bbs3)。同时,细胞胞吐作用(ectocytosis)最近被发现作为单细胞绿藻衣藻的替代纤毛出口途径出现。在胞吐作用过程中,纤毛或质膜的局部向外弯曲释放出细胞外囊泡(EV),称为ectosome或微囊泡。尽管纤毛胞吐作用可能代表衣藻属的专用方式,但由于纤毛具有暴露于细胞外环境的唯一的膜结构,哺乳动物和线虫EV的分析已经检测到部分在纤毛中发现的几种蛋白质,特别是多囊肾病(PKD)蛋白纤维细胞毒素/PKHD1和多囊蛋白-2/PKD2和突起特异性蛋白prominin。然而,EV也可以源自多泡体分泌,并且这种类型的EV(称为外泌体exosome)可以在与纤毛膜融合从而将蛋白质递送至纤毛。因此与纤毛相关的膜芽可以分为与纤毛融合的外泌体或从纤毛出芽的ectosomes。鉴于在蠕虫和哺乳动物中纤毛相关EV的起源的多个假说,纤毛胞吐作用的进化保守性仍有待确定。类似地,纤毛胞吐作用的条件性触发和分子机制以及吞吐之间的相互作用在很大程度上仍是未知的。最后,EV介导的功能范围仍然是一个悬而未决的问题。虽然EV最初被认为细胞清理的方式,但EV携带信息进行细胞间传递的设想已经取代了先前的假设,比如本研究中纤毛ectosome和纤毛相关EV的功能。
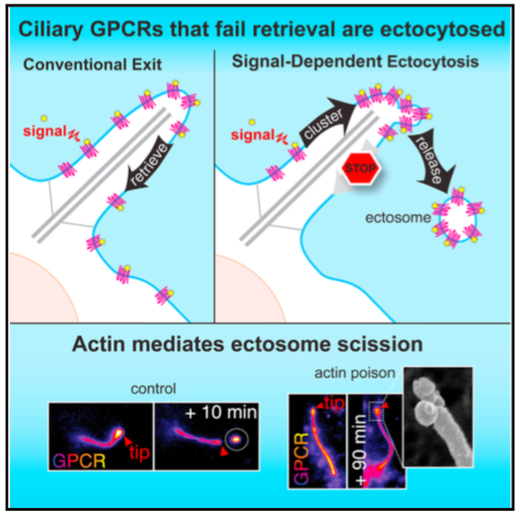
信号传导受体在激活Hedgehog等信号通路后会从纤毛吐出。来自斯坦福大学医学院的研究人员发现当激活的G蛋白偶联受体(GPCR)未能通过BBSome介导通过纤毛回到细胞时,这些GPCR在通过ectosome释放到细胞外前,会集中到纤毛膜芽的尖端。出乎意料,肌动蛋白actin和肌动蛋白调节剂drebrin和肌球蛋白myosin 6介导从纤毛尖端的ectosome释放。从纤毛中释放激活的的信号分子,这种镜像信号依赖的收回作用(retrieval)、信号依赖的胞吐作用是有选择性和有效的过程。与这些发现相一致,去除GPR161(一个Hedgehog信号的负调节器)的BBSome的缺失会有相应的胞吐作用的补偿,可以在Bbs突变体中进行适当的Hedgehog信号转导。在野生型细胞中,纤毛受体缺乏收回决定因子(retrieval determinants)如参与信号依赖性胞吐作用的NPY2R。研究人员的数据显示,信号依赖的胞吐作用会调节生理和病理背景下的纤毛信号。
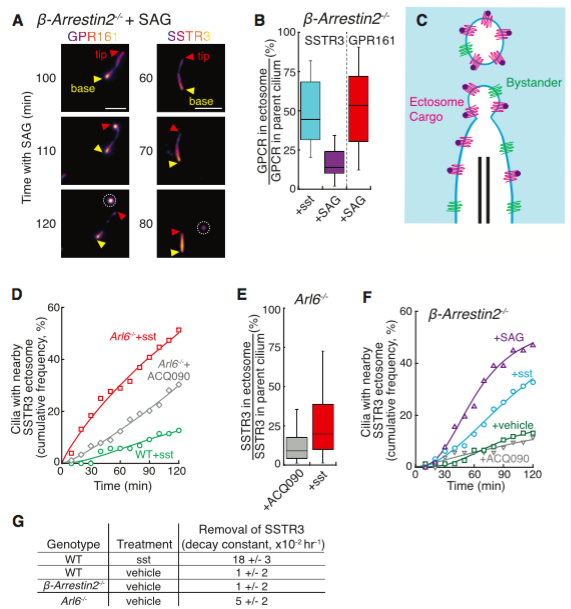
图:纤毛胞吐作用的特异性特征
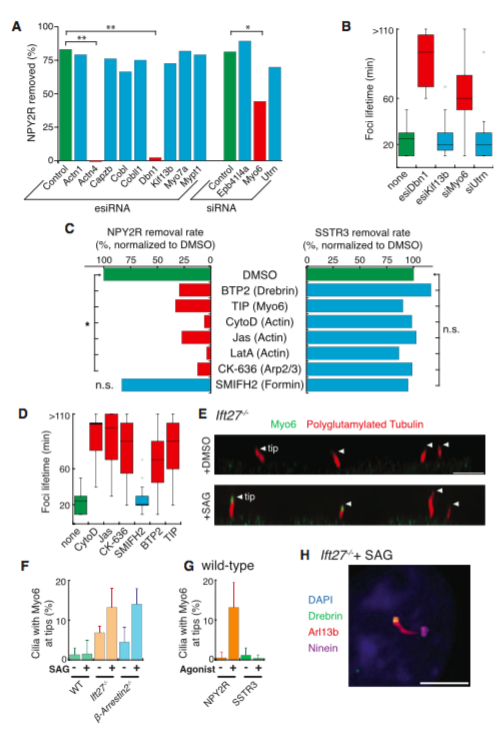
图:actin网络介导纤毛的胞吐释放细胞外囊泡
参考文献:Nager et al., An Actin Network Dispatches Ciliary GPCRs into Extracellular Vesicles to Modulate Signaling, Cell (2017), http://dx.doi.org/10.1016/j.cell.2016.11.036
版权归外泌体之家所有,欢迎转载,但请注明出处和原文链接!
原文下载和讨论请点击:http://www.exosome.com.cn/thread-1347-1-1.html?_dsign=bea4567c