细胞外囊泡(EVs)是由脂双层包裹的天然颗粒,由大多数哺乳动物细胞释放至细胞外环境中,用于细胞间通信。细胞外囊泡具有多样来源、不同大小及复杂分子组成,这为其特征描述和术语统一带来挑战。根据ISEV发布的指南,细胞外囊泡可分为外泌体(来源于内体系统)和微泡(来源于质膜)。此外,还有肿瘤囊泡、迁移囊泡及凋亡小体等术语,用于特定情境下描述特定来源的囊泡。然而,确定细胞外囊泡亚型需要明确的生物发生证据、精细的分离方法及验证的分子标志物。在本综述中,“细胞外囊泡”将作为通用术语,除非特别指明其亚细胞来源。
细胞外囊泡因其细胞来源及与环境的相互作用,携带脂类、蛋白质、代谢物和核酸等多种生物分子。作为活性载体,它们在输出与转运细胞组分方面表现出潜在的诊断、治疗及大分子递送应用价值。全面了解其生物发生途径、分子特征及作用机制,对于推动其在疾病诊断与治疗中的应用至关重要。
细胞外囊泡的尺寸范围从纳米到微米级,与非囊泡型颗粒高度相似,使得单囊泡特征研究更加困难。尽管无标记技术可评估囊泡的结构变量(如浓度、尺寸和内容物类型),但对于细胞相互作用的分析能力有限,并受到分离方法特异性与产量的制约。外源标记策略可研究囊泡的细胞摄取和体内分布,但无法揭示其生成过程,且可能导致非特异性标记残留。
合成生物学提供了一种基于基因编码系统的工程化工具,具有更高的特异性,可独立于自然过程精确操控生物学系统。这种技术为推进细胞外囊泡生物学及其在疾病管理中的应用提供了重要支持。
该综述重点探讨细胞外囊泡的生命周期,包括生成、运输及降解过程,概述用于研究其生命周期的基因编码系统,并展望未来技术的发展方向和应用潜力。
l 细胞外囊泡的生命周期
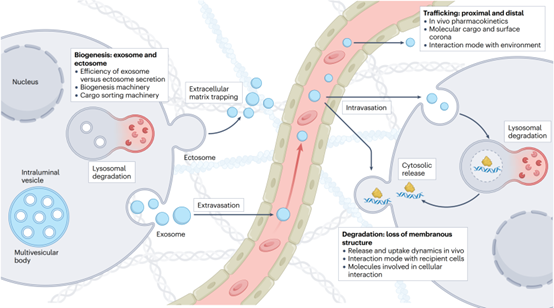
细胞外囊泡的生命周期包括生物发生、运输以及最终的降解。细胞外囊泡最初由细胞生成并释放到细胞外环境中,随后经历局部或全身的运输。在此过程中,它们的表面进一步功能化,结合分子形成“冠层”(corona layer)。最终,细胞外囊泡在受体细胞中被降解,而部分囊泡以完整形式排出体外,例如通过粪便、汗液、尿液和唾液等方式,从而被身体清除。
细胞外囊泡的生物发生、运输和降解
细胞外囊泡的生物发生
细胞外囊泡的生成涉及多种分子机制。外泌体的前体——内腔囊泡(ILVs)通过内体膜内陷形成多囊泡体(MVBs),ESCRT通路在其形成中起核心作用,但也存在神经酰胺或CD63依赖的ESCRT非依赖性通路。MVBs可与质膜融合释放外泌体,或与溶酶体融合降解。溶酶体功能障碍或抑制可增强囊泡分泌。微泡则通过质膜外突形成,携带胞质内容物释放。
尽管外泌体和微泡的来源不同,它们共享相似机制,如ESCRT和神经酰胺依赖通路。ILVs的分泌与降解、外泌体与微泡生成的效率对比仍不明确。现有体外分离方法难以捕捉囊泡的动态生成与再内吞过程。未来需开发敏感且特异的方法,量化囊泡生成并研究其与基因背景、环境条件及药理干预的关系,以揭示货物分选与生成的分子网络。
细胞外环境中的运输
细胞外囊泡被释放后,暴露于包含凝胶状基质和可溶分子的细胞外环境中。因其较高的变形能力及基质重塑能力,细胞外囊泡可能比合成颗粒更易在细胞外基质中运输。然而,细胞外基质的致密网状结构及囊泡与基质成分(如层粘连蛋白)的结合可能阻碍远距离运输,尤其是非循环或非腔面细胞来源的囊泡。在运输过程中,囊泡表面的“冠层”由周围分子决定,其动态形成增加了囊泡的分子复杂性及生物效应。
通过培养基和体液中囊泡的定量分析,可为囊泡在体内的药代动力学提供信息,这对制定生物工程策略及治疗性囊泡的给药方案至关重要。除通过载体传递分子实现细胞间信号传递外,细胞外囊泡还可能发挥独立于受体细胞的功能,如废物清除、诱饵效应及表面酶作用。因此,需全面了解囊泡在细胞外及细胞间的功能,以明确其在生物过程中的调控作用。此外,因囊泡携带反映疾病状态的分子,其在生物标志物发现中具有重要价值。未来需开发高精度技术,表征囊泡的内、表货物及冠层成分,以区分共分离的非囊泡分子。
受体细胞对囊泡的降解
细胞外囊泡的表面分子及其冠层蛋白在决定组织趋向性和细胞特异性中起重要作用。例如,表面蛋白和糖类的修饰会影响囊泡在体内外的细胞摄取效率,这提示囊泡摄取可能通过受体介导的内吞途径实现。内吞后,囊泡的命运主要分为两种:一是通过溶酶体降解提供营养支持;二是将囊泡组分递送至胞质中,这两种途径最终都会导致囊泡膜结构的丧失。胞质递送需要囊泡与质膜或内体膜融合,或诱发受体细胞内体破裂。然而,溶酶体降解是主要途径,而胞质递送的效率较低,但可通过融合蛋白的过表达来增强这一过程。
目前,囊泡与受体细胞相互作用的分子机制仍未被充分揭示。然而,明确这些分子机制对于判断囊泡是否通过接触依赖信号(邻接分泌信号)或胞内货物递送影响受体细胞至关重要。此外,监测囊泡的降解过程有助于识别货物递送在器官、细胞及亚细胞水平上的限制步骤,从而推动治疗性囊泡的发展。值得注意的是,天然囊泡的生物分布和信号特性难以通过外源性囊泡完全复制,这突显了开发灵敏工具以精确量化内源性囊泡的重要性。
l 用于研究细胞外囊泡生物发生的基因标签
基因编码系统可提供敏感且特异的方式来研究复杂的生物事件。重要的是,基因标签可以被编程用于研究细胞外囊泡生命周期的不同方面。通过将基因标签与在细胞外囊泡生产细胞中表达并被整合到囊泡中的结构域或基序融合,可以对细胞外囊泡进行基因标记。这种方法可用于实时成像细胞外囊泡的生物发生,筛选影响囊泡产量的因素,并阐明囊泡生物发生中的分子网络。
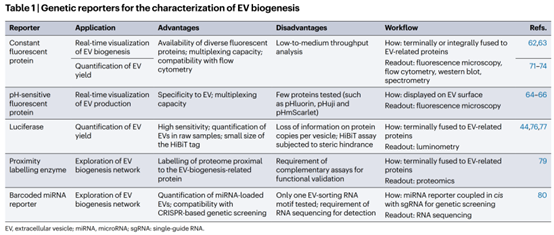
细胞外囊泡生物发生的实时可视化
荧光信号的时空动态可揭示分子运动,因此,通过将荧光蛋白报告基因与细胞外囊泡相关结构域融合,可用于监测囊泡的生物发生。基因工程技术允许利用全光谱的荧光蛋白。细胞外囊泡膜通常富含四跨膜蛋白(如CD63和CD9)。通过标记CD63-mCherry(红色荧光蛋白)和CD9-GFP(绿色荧光蛋白)并利用共聚焦显微镜,可追踪这两种蛋白的亚细胞定位。研究发现,CD63主要定位于细胞内腔室,而CD9则位于质膜。因此,含有更多CD63的囊泡可能来源于内腔室,可归类为外泌体。
通过这些工具,细胞外囊泡相关蛋白的位置和运动,以及外泌体的释放过程得以观测。然而,目前仍需开发工具以同时追踪内腔囊泡生成、外泌体释放及微泡分泌的全过程。
影响细胞外囊泡产量的因素
通过荧光蛋白与囊泡相关蛋白的融合,可用荧光信号测量细胞外囊泡的产量并检测囊泡与生产细胞。例如,稳定表达荧光蛋白标记CD63的细胞可用于筛选影响外泌体产量的化合物,假设流式细胞术检测到的细胞荧光减少与囊泡释放相关。然而,这一假设面临分泌蛋白可能为游离或囊泡形式的挑战。单囊泡流式细胞术可用于检测未分离样本中的荧光囊泡,而荧光相关光谱技术则可基于扩散时间区分囊泡GFP与游离GFP。定量总囊泡货物时,需结合其他方法,如蛋白印迹或酶联免疫吸附测定。
细胞外囊泡生物发生的分子网络
荧光蛋白或萤火虫素酶的基因标记需要与单一囊泡分选结构域融合,限制了对伴侣分子的研究。相比之下,邻近标记通过酶生成活性自由基,标记邻近蛋白。例如,将生物素连接酶BirA*与自噬相关蛋白LC3融合,可通过生物素化和质谱检测识别与囊泡相关的LC3互作蛋白,揭示自噬与囊泡货物分选的联系。
l 用于捕获细胞外囊泡的基因标签
内腔报告蛋白是测量血浆中细胞外囊泡及评估其货物(包括小分子、大分子蛋白和核酸)的理想替代工具。
血浆中细胞外囊泡的药代动力学
携带荧光蛋白或萤火虫素酶的细胞外囊泡可通过单囊泡流式细胞术、显微镜或发光检测直接定量,其中发光法灵敏度较高。结合荧光蛋白和萤火虫素酶(如mNG-HiBiT或CD63-NanoLuc)实现双模态检测已应用于药代动力学研究。研究发现,HEK293T来源的囊泡在小鼠静脉或腹腔注射后迅速降解,经皮下注射则在血浆中检测到的活性极低。
细胞外囊泡内在/相关分子
由于细胞外囊泡在体液中相对稀少,直接分子表征较为困难,因此囊泡富集方法至关重要。通过在囊泡表面添加基因标签,可利用免疫磁分离实现高特异性囊泡富集。例如,将FLAG标签插入CD63的胞外环,通过抗FLAG磁珠可纯化外泌体,并成功从小鼠肝脏和肠道来源的囊泡中分离内源性囊泡。这些基因标签技术不仅可从生物样本中分离囊泡,还能直接标记囊泡相关分子,为其分子特征绘制提供了新方法。
l 探究细胞外囊泡的命运
多组学技术可以揭示细胞外囊泡对细胞的时空影响,但无法确定这些影响是否源于囊泡与细胞的直接相互作用。然而,识别受体细胞并阐明细胞外囊泡与细胞的相互作用模式,对于理解囊泡的命运及功能影响至关重要。
细胞外囊泡的受体细胞
囊泡的生物分布:揭示细胞外囊泡的生物分布是识别受体细胞的前提。萤光素酶成像可实现非侵入性、实时及组织水平的囊泡分析。
单细胞分析与荧光标记:荧光蛋白适于与抗体表型分析结合进行流式细胞术。
Cre–loxP重组系统:Cre–loxP系统可用于长期追踪细胞外囊泡的受体细胞。
CRISPR基因编辑:CRISPR系统也可用于细胞系追踪。
细胞外囊泡绑定细胞追踪:与Cre–loxP和CRISPR依赖胞质递送不同,外囊泡绑定的细胞无法通过这些系统识别。
细胞外囊泡与受体细胞的相互作用模式
依赖内吞的相互作用:细胞外囊泡通过内吞作用进入受体细胞,但其表面结合、内体捕获和胞质递送的区分较为困难。
非依赖内吞的相互作用
囊泡与受体细胞的表面相互作用对旁分泌信号传递及细胞内摄具有重要意义。
l 技术考量
基因编码系统的应用推动了对细胞外囊泡生命周期的研究,但对囊泡生产细胞的遗传操作可能改变囊泡的分子特征,从而影响其与环境分子和受体细胞的相互作用。特别是囊泡表面改造可能影响蛋白冠的组成,改变细胞趋性。遗传标签易受蛋白酶切割影响,并可能因过表达而改变亚细胞定位或囊泡生物发生途径。
目前,大多数基因系统依赖单一分选结构域,这可能遗漏未表达该结构域的囊泡亚群。整合多种分选结构域信息有助于得出更全面的结论。
l 展望
细胞外囊泡研究快速发展,在阐明其生物学功能、开发治疗策略及诊断标志物方面取得进展。然而,其在维持稳态及致病中的作用仍不明确。目前研究集中于细胞间分子转运,但对囊泡独立于细胞摄取的胞外功能(如废物处理、诱饵效应及表面酶活性)了解有限,需开发精准标记囊泡货物与区分表面和内腔分子的技术。
囊泡的分子异质性表明特定亚群可能更擅长介导细胞间货物交换,但现有方法难以捕捉稀有但生物学相关的囊泡-细胞相互作用。优化标记策略并开发适用于天然囊泡的系统是关键。此外,RNA在囊泡功能中的作用需深入探索,如利用荧光RNA适配体标记和成像特定RNA物种以研究其转运机制。
尽管存在挑战,基因编码系统的应用对揭示细胞外囊泡的生物学特性、标志物发现及治疗开发具有重要意义。
参考文献:
Zheng, W., Roudi, S., Zhou, H. et al. Genetic tools for investigating the life cycle of extracellular vesicles. Nat Rev Bioeng 3, 505–520 (2025). https://doi.org/10.1038/s44222-025-00286-6