骨关节炎(OA)作为全球高发的退行性关节疾病,其发病机制与肠道菌群(GM)的失调密切关联,形成“肠道-关节轴”这一新兴研究范式。近年来,细菌外囊泡(BEV)作为肠道菌群与宿主交互的核心介质,因其独特的生物学特性可能成为破解OA病理机制的关键。BEV是由革兰氏阴性菌(G⁻)与阳性菌(G⁺)分泌的纳米级磷脂囊泡,可携带活性成分,突破肠道屏障进入循环系统,调控关节免疫微环境与软骨代谢平衡。相较于传统药物递送系统,BEV凭借高产率、低免疫原性及易工程化修饰的优势,不仅能作为肠道菌群失调的“信号放大器”反映OA早期病理特征,还可通过靶向递送抗炎因子、基因编辑工具或促修复分子,精准干预关节炎症与软骨退化。
上海交通大学医学院附属新华医院苏佳灿教授、长海医院崔进副教授团队联合中国人民解放军联勤保障部队第九二0医院谭洪波副主任医师在Gut Microbes杂志上发表题为“Bacterial extracellular vesicles in osteoarthritis: a new bridge of the gut-joint axis”的论文,主要介绍了BEV在“肠道-关节轴”中的调控作用,揭示其从诊断标志物到治疗载体的全链条潜力,为OA治疗提供新视角。 第一作者牛鲁豫、陈万卓、尹志峰,通讯作者谭洪波、崔进、苏佳灿。
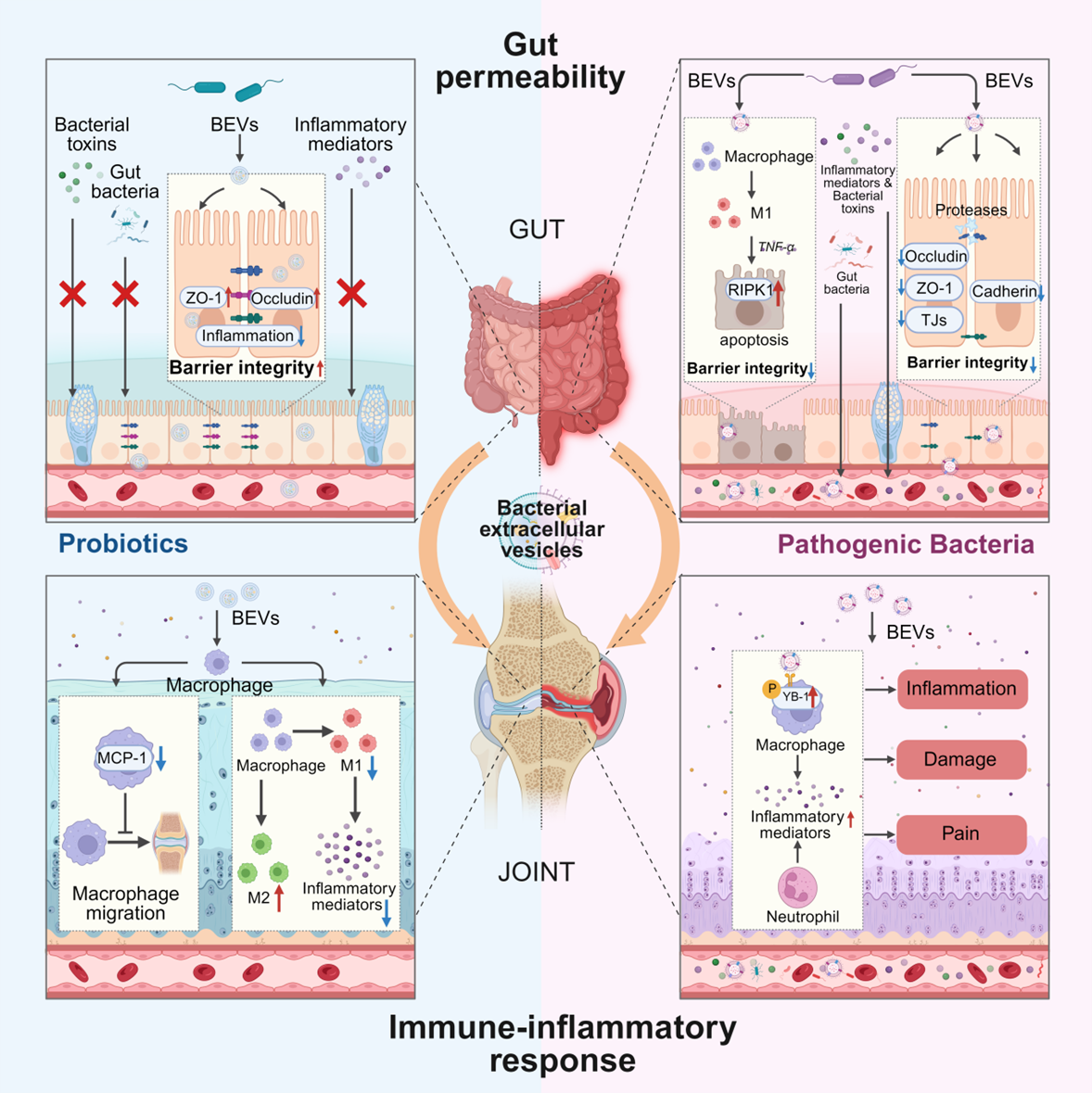
天然的BEV通过携带多种生物活性分子调控OA的病理进程。BEV的货物主要分为三类:膜相关货物(如脂多糖LPS和肽聚糖),通过激活Toll样受体和NOD样受体引发关节炎症;细胞质货物(如短链脂肪酸和色氨酸代谢物),通过调节免疫平衡和软骨细胞代谢改变OA进展;遗传货物(如细菌DNA和RNA),可能通过迁移至关节组织影响软骨基因表达。BEV的异质性源于其形成机制(如G-菌的外膜囊泡OMV和G+菌的胞膜囊泡CMV),导致不同货物选择性富集。这些货物通过调控肠道通透性、免疫炎症反应及软骨稳态,成为连接肠道菌群与关节健康的关键桥梁,为OA治疗提供了新靶点(图1)。
图1.BEV在肠关节轴中的作用概述
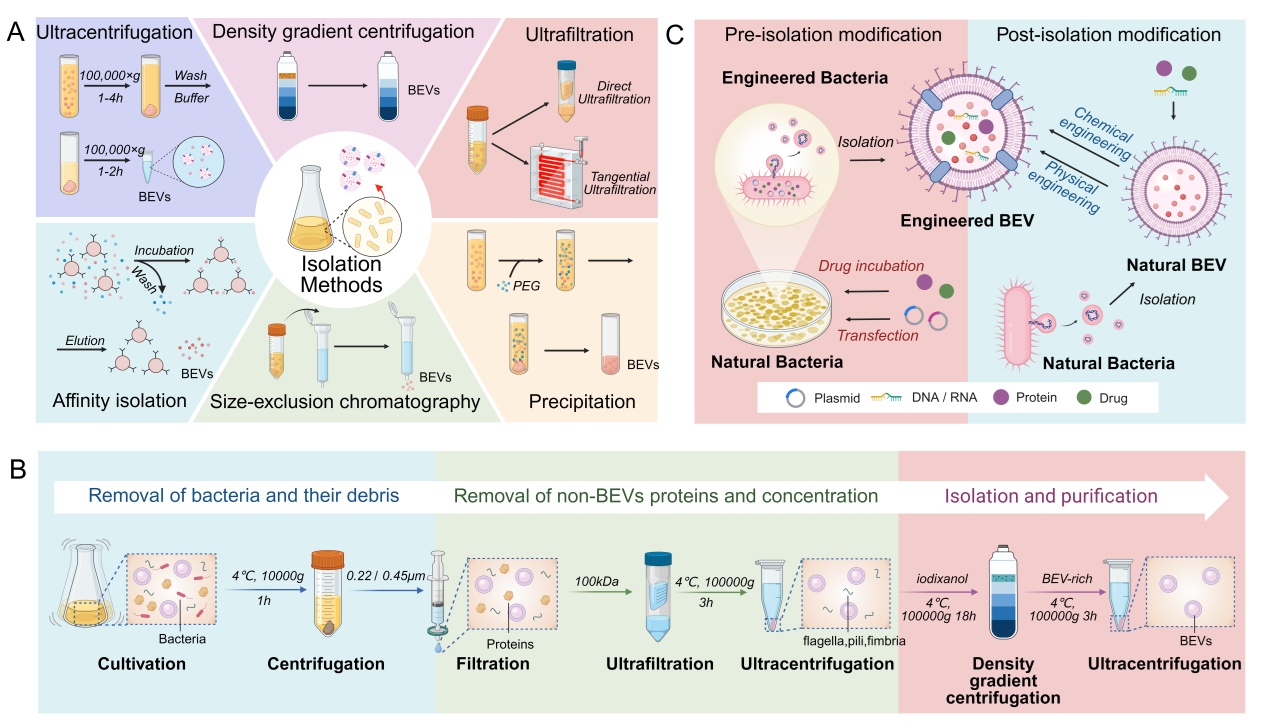
为实现BEV在OA治疗中的精准应用,工程化改造策略聚焦两大方向:分离纯化优化与靶向功能增强。通过超速离心、密度梯度离心等技术提升BEV纯度,结合发酵工艺优化大幅提高产量。改造策略则包括预分离修饰和前分离修饰两种,前者通过基因编辑使益生菌表达特异性蛋白,从而产生某种特殊功能的囊泡;后者则是直接对BEV进行加工修饰。工程化BEV兼具天然囊泡的低毒性与高载药能力,可突破关节药物递送屏障,通过调控免疫炎症和促进软骨修复实现多效治疗。尽管面临规模化生产与安全性挑战,但其作为“智能纳米载体”的潜力为OA个体化治疗开辟新路径(图2)。
图2.工程化分离修饰BEV的方法
基于此BEV在OA诊疗中展现出多维度创新潜力:可能作为诊断标志物,可通过分析血液或粪便中BEV实现OA早期筛查;在治疗层面,通过抑制致病菌BEV分泌或补充益生菌来源BEV重塑肠道-关节免疫平衡。工程化BEV进一步突破传统局限,通过靶向修饰精准递送miRNA、抗炎因子或促修复蛋白,直接调控软骨代谢并抑制炎症。此外,BEV与生物材料结合协同促进软骨再生。凭借天然低免疫原性、高载药量及跨屏障能力,BEV正从实验室迈向临床,为OA治疗提供创新理论与技术突破(图3)。
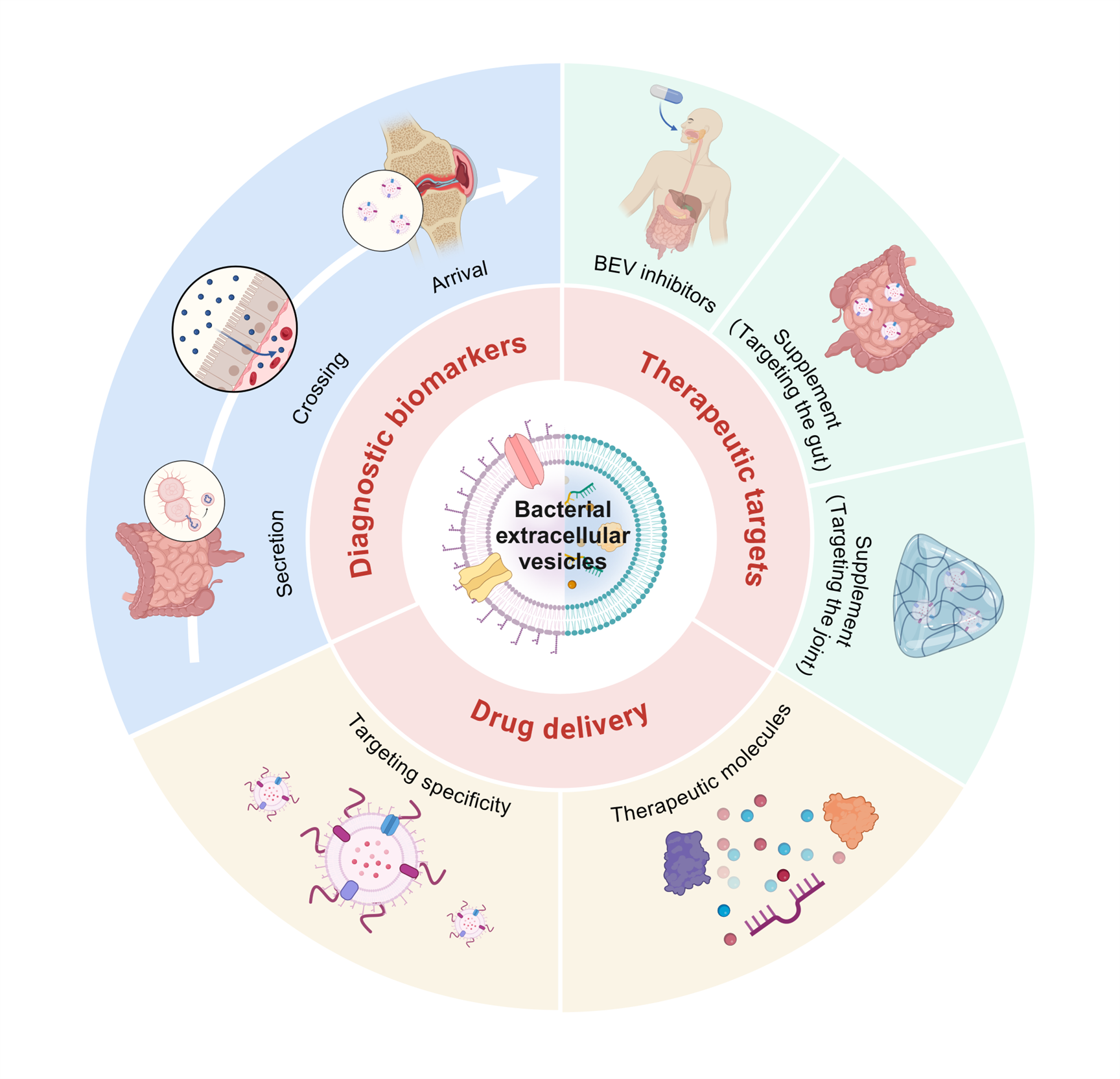
图3.BEV应用于OA诊疗的概述
参考文献:
Bacterial extracellular vesicles in osteoarthritis: a new bridge of the gut-joint axis. Gut Microbes (2025). http://dx.doi.org/10.1080/19490976.2025.2489069.
外泌体资讯网 Gut Microbes |上海交大医学院附属新华医院苏佳灿教授团队:骨关节炎中的细菌胞外囊泡:肠道-关节轴的新桥梁