乳腺癌转移到大脑是临床面临的一大问题,发生率呈上升趋势。然而肿瘤细胞如何适应远处的脑部环境以促进肿瘤定植的潜在机制仍然知之甚少。大脑的一个独特代谢特征是神经元和星形胶质细胞之间通过谷氨酸、谷氨酰胺和乳酸之间的偶联。来自美国加州大学圣迭戈分校的Shizhen Emily Wang研究团队发现,具有高脑转移潜能的乳腺癌细胞释放的细胞外囊泡携带高水平的miR-199b-5p,在大脑微环境中使谷氨酸、谷氨酰胺和乳酸发生细胞外滞留,重新编程神经喜报代谢为脑转移提供能量。相关内容以“Breast cancer cell-secreted miR-199b-5p hijacks neurometabolic coupling to promote brain metastasis”为题在线发表于5月29日的国际知名综合性学术期刊Nature Communications杂志上。
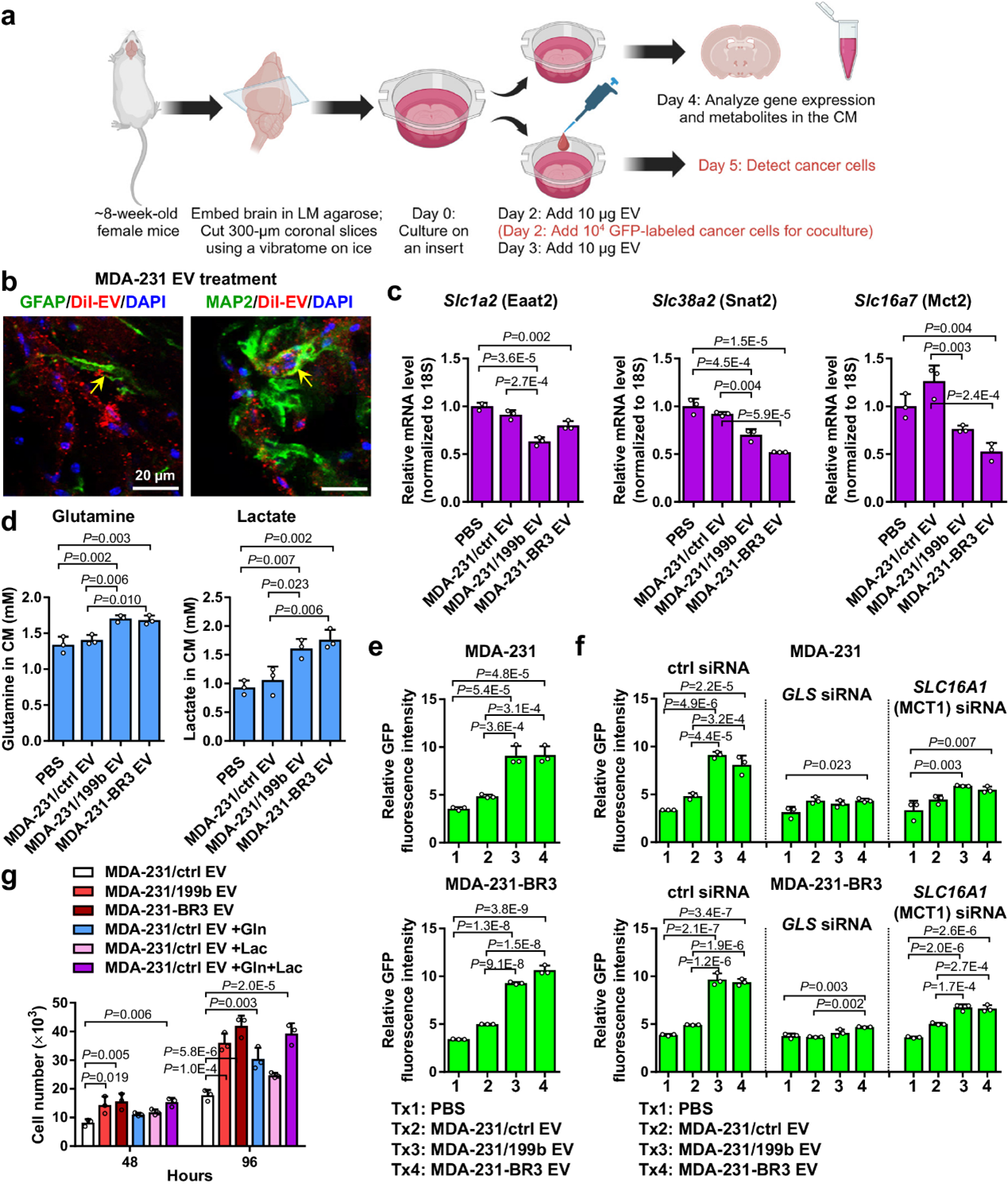
转移是癌症患者死亡的主要原因。对于乳腺癌(breast cancer,BC),约50%的接受化疗或激素治疗的患者会发展出远处转移。转移性乳腺癌(Metastatic BC,MBC)患者的中位生存期为1-2年。10-16%的MBC患者报告有症状性脑转移,但实际发生率更高,因为30%的患者在尸检时被发现有脑转移。脑转移在雌激素受体阴性、HER2阳性肿瘤或三阴性(TN)肿瘤中更为常见,特别是在化疗或曲妥珠单抗治疗后,部分原因是血脑屏障(BBB)无法被大多数治疗药物穿透。因此,随着MBC的全身治疗的改善,预计乳腺癌向脑部转移将变得更为普遍,因为肿瘤细胞越来越多地迁移到“避难所”脑部微环境以逃避治疗。对于脑转移的机制和目前的治疗,主要是放疗和手术切除,对于靶向脑的MBC治疗方法十分有限。最近的研究发现,在肿瘤细胞来源的细胞外囊泡(EVs)和其他分泌因子的作用下,在肿瘤发生前/转移阶段适应远端环境对于转移的发展至关重要。与此同时,脑实质细胞通过分泌促癌、促血管生成或免疫调节细胞因子或EVs等,已显示出在促进原发性和转移性脑肿瘤方面发挥着新兴作用。EV的货物,包括miRNA,可以转移到远处的细胞以调节细胞功能。循环miRNA也已经作为癌症诊断和预后的潜在生物标志物出现。在这里,研究人员特别关注BC来源的EVs的miRNA货物在适应脑部微环境细胞以促进脑转移中的作用。在大脑中,突触活动与神经元和星形胶质细胞之间的代谢物流动紧密结合。星形胶质细胞通过将谷氨酸转化为谷氨酰胺,迅速清除突触间隙中由谷氨酸能源神经元分泌的兴奋性神经递质谷氨酸,这一过程促进了持续的神经元活动。这不仅使谷氨酰胺在谷氨能神经元中得以有效补充,而且还保护了神经元免受长时间暴露于谷氨酸的高度兴奋性影响。同时,星形胶质细胞也通过糖酵解产生乳酸,并将其输送到神经元。由于谷氨酸抑制葡萄糖进入神经元,因此人们认为乳酸是为神经元提供能量的必要底物,并介导了从星形胶质细胞到神经元的净能量转移。在能量匮乏的条件下,如低血糖和神经系统活动剧烈时,星形胶质细胞利用糖原储备产生乳酸,以保护神经元并确保神经元功能的保留。谷氨酸-谷氨酰胺循环和乳酸穿梭进一步协调了神经元活动与能量代谢的耦合。由于谷氨酸能神经元活动引起的增加的细胞外谷氨酸刺激了星形胶质细胞中的葡萄糖摄取和糖酵解,从而导致产生更多的乳酸转移到神经元。因此,具有独特的细胞间转运谷氨酸、谷氨酰胺和乳酸的神经元-星形胶质细胞代谢偶联对突触活动和正常脑功能至关重要,并在学习和记忆、睡眠剥夺、神经炎症和神经退行性疾病等行为和病理条件下得到动态调节。在这项研究中,研究人员确定miR-199b-5p(简称为miR-199b)是一种BC来源的调节因子,影响了神经元和星形胶质细胞之间的代谢偶联。结果显示,具有高发展脑转移潜能的乳腺癌细胞释放的细胞外囊泡携带高水平的miR-199b,与其他器官转移的乳腺癌患者相比,血液中的miR-199b水平更高。miR-199b靶向溶质载体转运蛋白(星形胶质细胞中的SLC1A2/EAAT2和神经元中的SLC38A2/SNAT2和SLC16A7/MCT2),以控制神经元-星形胶质细胞代谢偶联,导致代谢物(包括谷氨酸、谷氨酰胺和乳酸)的细胞外滞留,进而促进了转移到大脑的乳腺癌细胞的生长。参考文献:Breast cancer cell-secreted miR-199b-5p hijacks neurometabolic coupling to promote brain metastasis. Nat Commun. 2024 May 29;15(1):4549.




