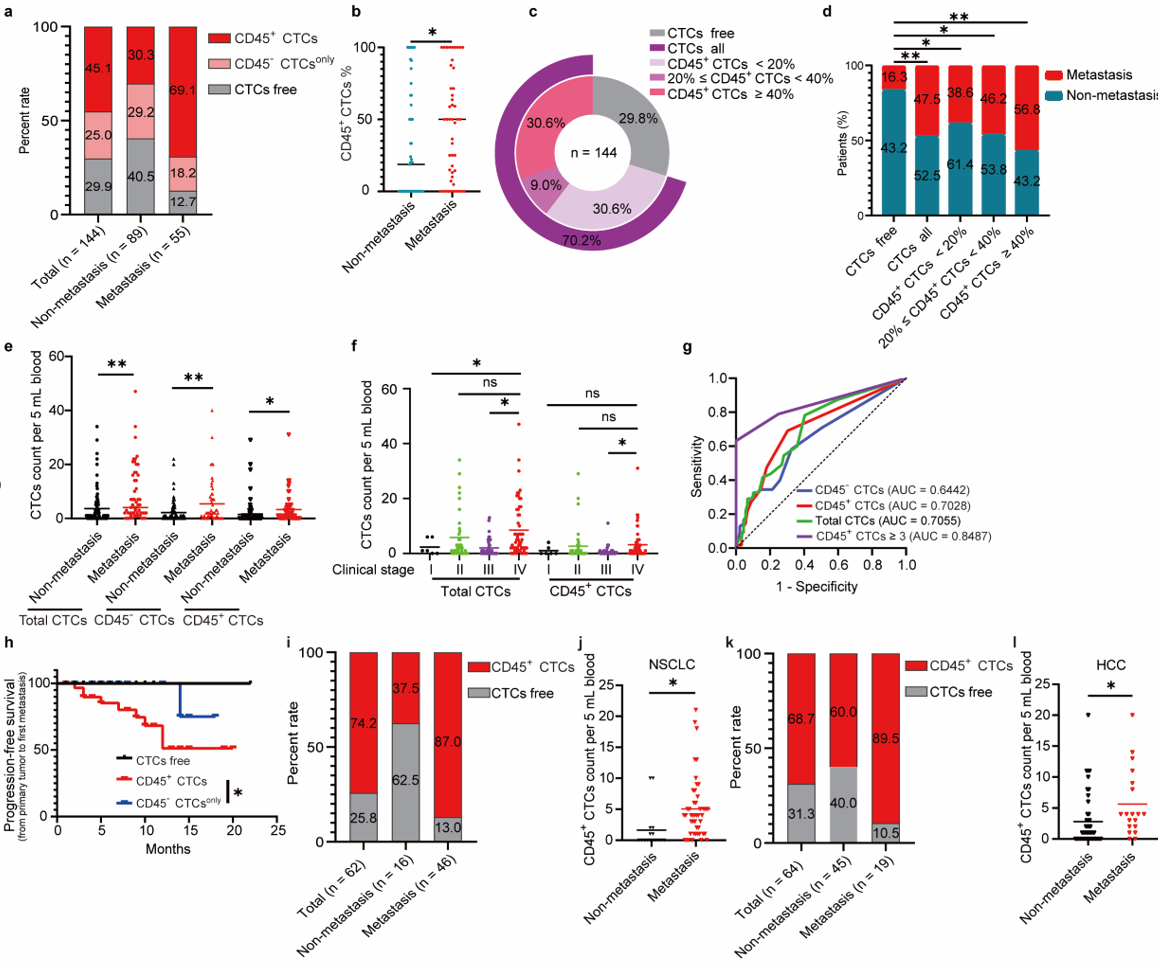
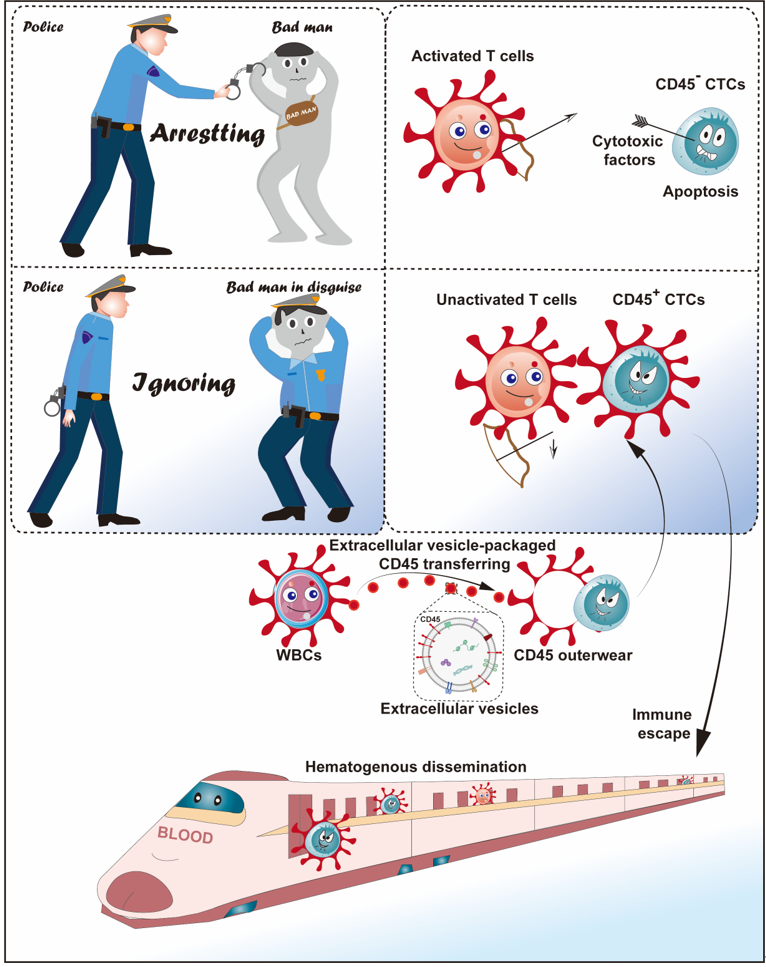
循环肿瘤细胞(CTCs)的血行播散是肿瘤发生远处转移的关键环节,同时CTCs作为液体活检的主要标志物,在评估肿瘤患者的预后、疗效以及研究复发转移和耐药机制等方面都具有重要的临床意义。然而CTCs在血液循环中如何逃避免疫监视实现远处转移的机制尚不清楚,因而尚缺乏有效抑制CTCs播散转移的临床治疗方案。2024年4月5日,中山大学肿瘤防治中心符立梧教授团队在Signal Transduction and Targeted Therapy杂志发表题为“Circulating tumor cells shielded with extracellular vesicle-derived CD45 evade T cell attack to enable metastasis”的研究论文(2024 Apr 5;9(1):84),证实了一类与转移及不良预后密切相关的CTCs亚型,即CD45阳性的CTCs(CD45+CTCs)。研究发现CD45+ CTCs通过借助白细胞细胞外囊泡(EVs)的CD45逃避T细胞杀伤作用。机制上,CTCs通过其获得的CD45减弱TCR信号逃避T细胞杀伤作用实现远处转移。
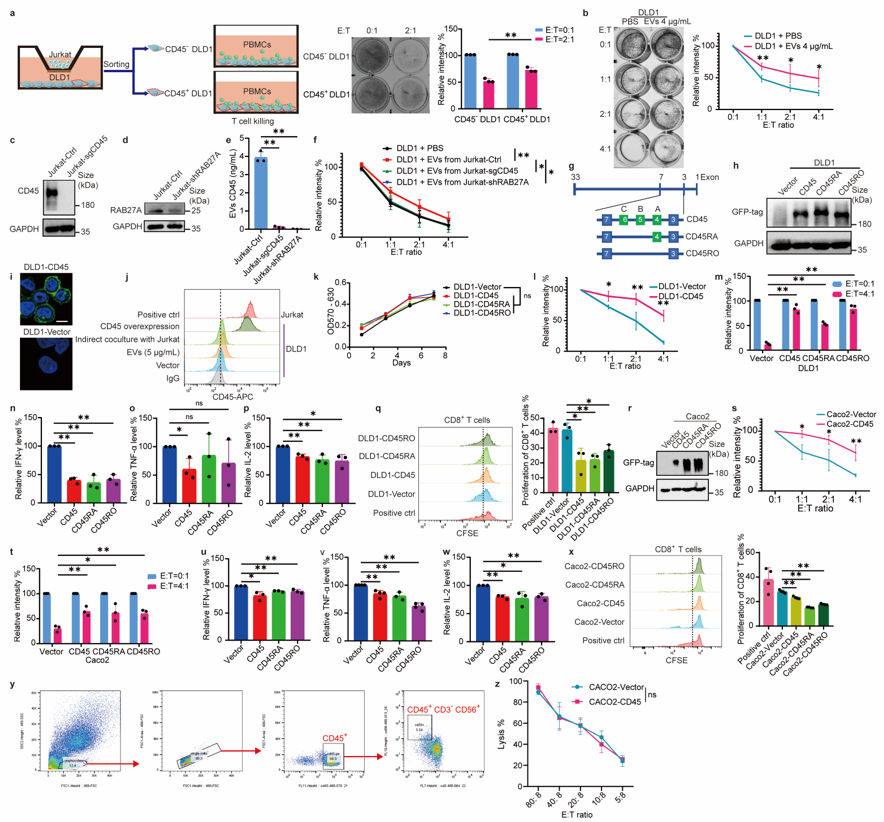
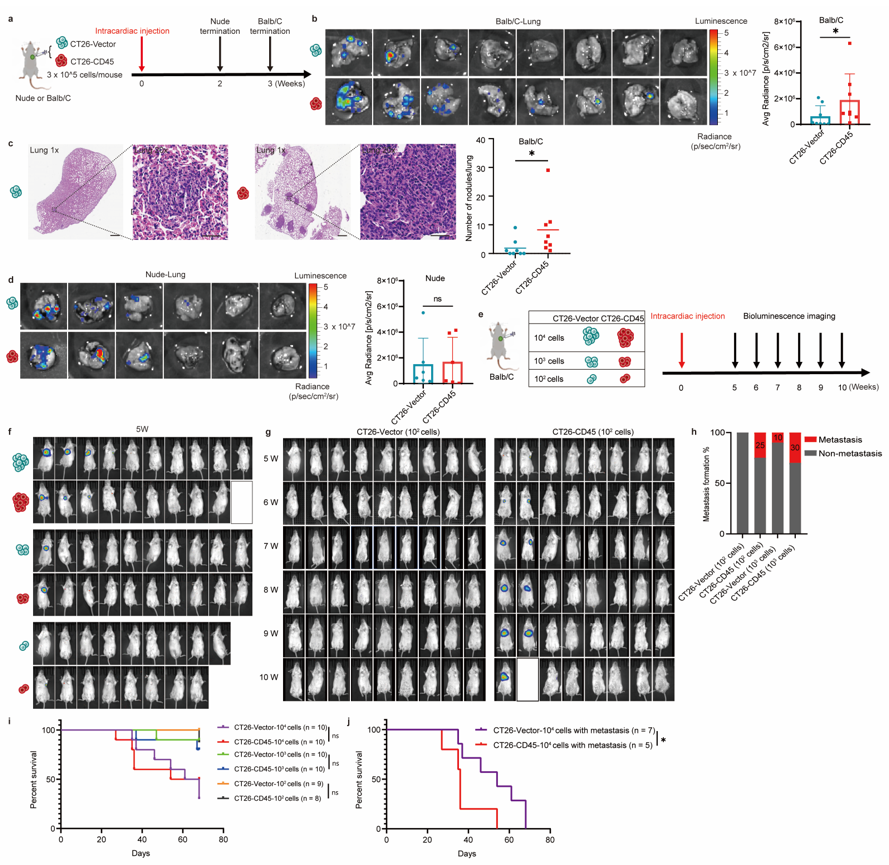
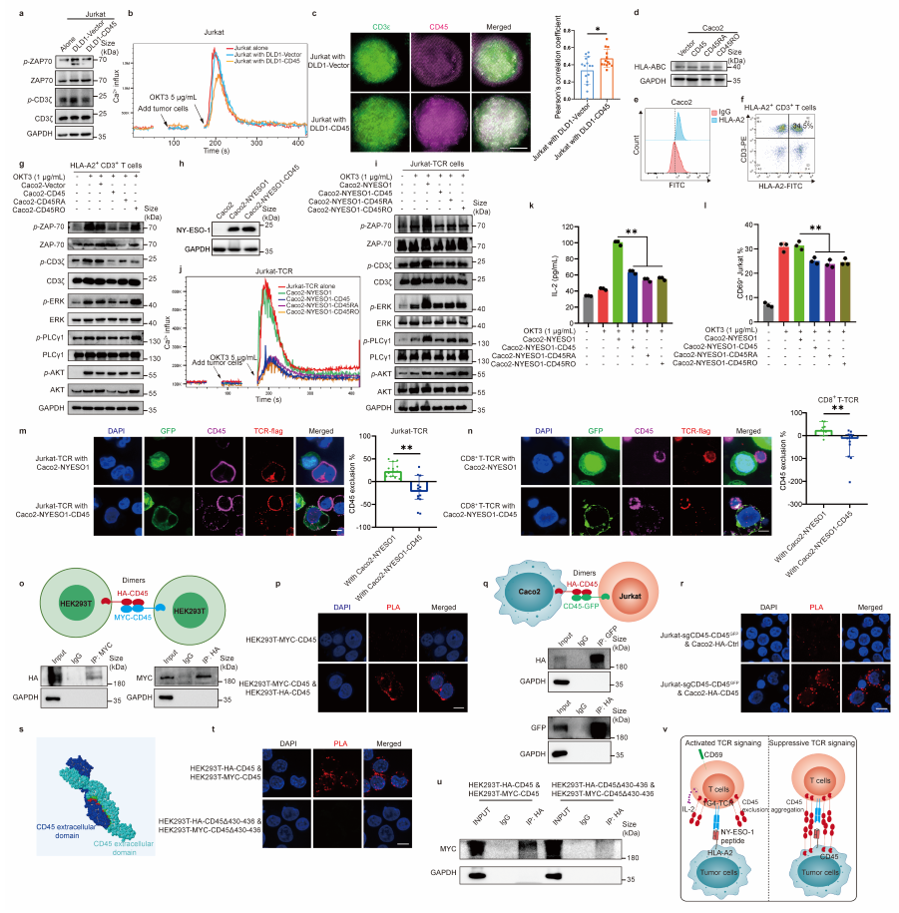
以往的研究虽然已经报道CD45+CTCs的存在,但未在多种实体瘤患者血液中得到验证,而且CD45的来源及功能尚不清楚 1,2。本研究通过微流控的方法分离不同肿瘤患者外周血CTCs,联合免疫荧光染色、单细胞拷贝数测序等证实在结直肠癌、非小细胞肺癌、乳腺癌和肝癌患者中均可检测到CD45+ CTCs(图一),且CD45+CTCs与高转移潜能及患者不良预后密切相关(图二)。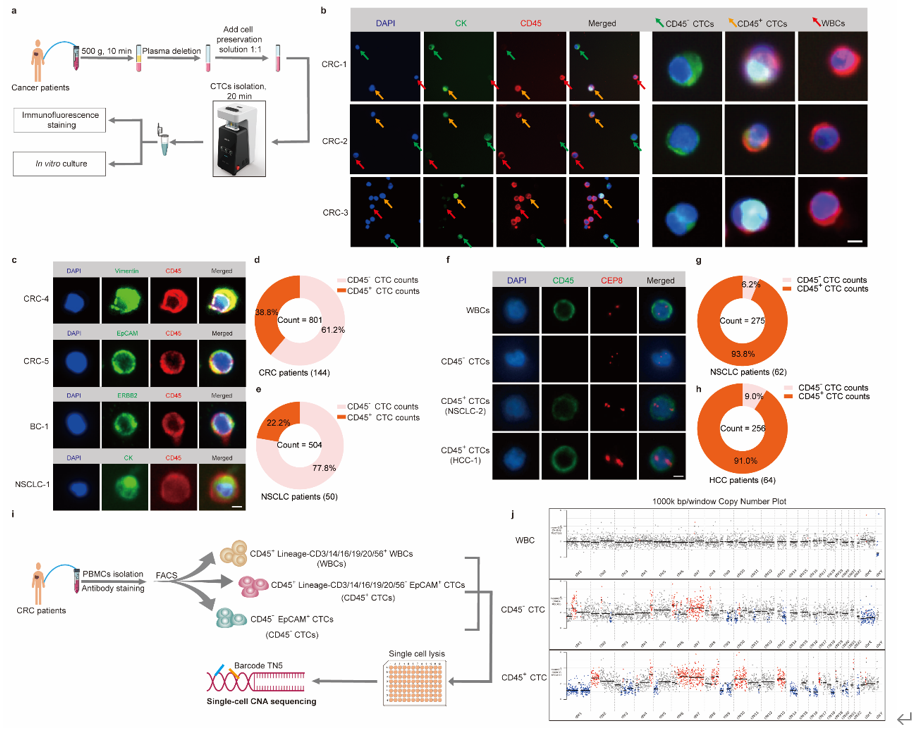 图一、CD45+CTCs存在于多种实体瘤患者血液中通过对CD45+CTCs的CD45来源及功能探究发现,CTCs通过白细胞来源的细胞外囊泡(EVs)获得CD45蛋白,CD45+CTCs抵抗T细胞杀伤且抑制T细胞活化,而对NK细胞杀伤则无抵抗作用(图三)。进一步应用心内注射的Balb/C鼠转移模型证实CD45+ CTCs较CD45- CTCs具有更强的转移能力(图四)。机制研究表明CD45+CTCs通过与T细胞发生细胞间CD45-CD45二聚化,阻止CD45从TCR-pMHC免疫突触位置分离,随后抑制TCR信号激活,进而逃避T细胞杀伤(图五)。综上所述,本研究鉴定了能够逃避免疫杀伤且具有高转移潜能的特异性CD45+ CTCs亚型,解析了其借助CD45逃避免疫清除的分子机制,为准确评估肿瘤进展、预测复发和转移提供了新视角。图六、CTCs借助细胞外囊泡CD45逃避免疫监视实现远处转移该研究得到国家自然科学基金(No: U21A20421, 82073882, 82203649)、广州市科技攻关项目 (No: 2023B03J0029)、国家重点研发计划项目 (No: 2022YFE0209700)等基金项目的支持。Circulating tumor cells shielded with extracellular vesicle-derived CD45 evade T cell attack to enable metastasis, Signal Transduct Target Ther. 2024 Apr 5;9(1):84. doi: 10.1038/s41392-024-01789-1.
图一、CD45+CTCs存在于多种实体瘤患者血液中通过对CD45+CTCs的CD45来源及功能探究发现,CTCs通过白细胞来源的细胞外囊泡(EVs)获得CD45蛋白,CD45+CTCs抵抗T细胞杀伤且抑制T细胞活化,而对NK细胞杀伤则无抵抗作用(图三)。进一步应用心内注射的Balb/C鼠转移模型证实CD45+ CTCs较CD45- CTCs具有更强的转移能力(图四)。机制研究表明CD45+CTCs通过与T细胞发生细胞间CD45-CD45二聚化,阻止CD45从TCR-pMHC免疫突触位置分离,随后抑制TCR信号激活,进而逃避T细胞杀伤(图五)。综上所述,本研究鉴定了能够逃避免疫杀伤且具有高转移潜能的特异性CD45+ CTCs亚型,解析了其借助CD45逃避免疫清除的分子机制,为准确评估肿瘤进展、预测复发和转移提供了新视角。图六、CTCs借助细胞外囊泡CD45逃避免疫监视实现远处转移该研究得到国家自然科学基金(No: U21A20421, 82073882, 82203649)、广州市科技攻关项目 (No: 2023B03J0029)、国家重点研发计划项目 (No: 2022YFE0209700)等基金项目的支持。Circulating tumor cells shielded with extracellular vesicle-derived CD45 evade T cell attack to enable metastasis, Signal Transduct Target Ther. 2024 Apr 5;9(1):84. doi: 10.1038/s41392-024-01789-1.外泌体资讯网 Signal Transduct Target Ther|中山大学符立梧:循环肿瘤细胞免疫逃逸新发现:CD45伪装的循环肿瘤细胞