乳腺癌的治疗复杂性在于其异质性极高,治疗成效不仅取决于肿瘤本身的特性,还受到肿瘤所处微环境,尤其是微生物组的深刻影响。肿瘤内部的微生物不仅能够促进或抑制肿瘤的生长和扩散,还能够显著影响患者对各种治疗方案的反应,为开发更有效的癌症治疗策略开辟了新靶标。但是,目前直接采用抗菌策略,比如使用抗生素来调节肿瘤微环境中的菌群平衡,以期增强癌症治疗效果,这一方法存在显著的不确定性。其根本问题在于抗生素的非特异性,它们不能有效区分对人体有益的菌和有害的菌,且使用抗生素可能伴随着一系列潜在的副作用。因此,开发出既能够精准靶向肿瘤微环境中的特定微生物群体,又能最小化不良反应的新型治疗策略,成为当前癌症治疗研究的重要方向。近日,南京邮电大学汪联辉和丁显光教授团队合作在ACS Nano上报导了一种基于微流控芯片的细菌来源囊泡矿化疫苗的治疗策略。相关研究成果标题为“Programmed Nanocloak of Commensal Bacteria-Derived Nanovesicles Amplify Strong Immunoreactivity against Tumor Growth and Metastatic Progression” (doi: 10.1021/acsnano.3c13194)。
基于临床上对乳腺癌的测序和筛查,研究者鉴定出乳腺癌患者组织内丰富的共生细菌。以此为特征,提出可以在体外对这类共生菌分泌的囊泡进行工程化改造,构建抗菌/抗癌疫苗。他们在微流控芯片上开发了一种纳米斗篷技术,通过氧化锰(MnO2)界面封装BEV,形成cloaked BEV (cBEV)。这种囊泡的界面矿化不仅克服了暴露的BEV诱导的不良副作用,保护载体免受外界环境的破坏,还能在适当的时机响应性释放,确保免疫激活物质在肿瘤微环境中的有效释放。当cBEV被DC细胞摄取后,细胞内溶酶体环境使得氧化锰外壳溶解,暴露的BEVs通过促进B细胞分泌IgG抗体激活体液免疫,有效抑制肿瘤共生菌的生长;同时,氧化锰外壳溶解释放的锰离子激活cGAS-STING通路促进树突状细胞成熟,进一步将特异性抗原呈递给T细胞,以增强抗肿瘤免疫。在体内预接种cBEV纳米疫苗可有效抑制瘤内菌以及肿瘤生长,当与免疫检查点抑制剂PD-L1抗体联合治疗后明显抑制肿瘤生长并减少肺转移。(a)不同处理组和平均肿瘤生长曲线。(b)不同组肺转移的HE切片和肺结节定量。图 2. 基于瘤内共生菌,在微流控芯片上构筑共生菌衍生囊泡的疫苗。(a,b)材料制备示意图。(c)BEV和cBEV的代表性TEM图像。(d)cBEV的元素分析。(e) BEV和cBEV在不同条件下的蛋白稳定性分析。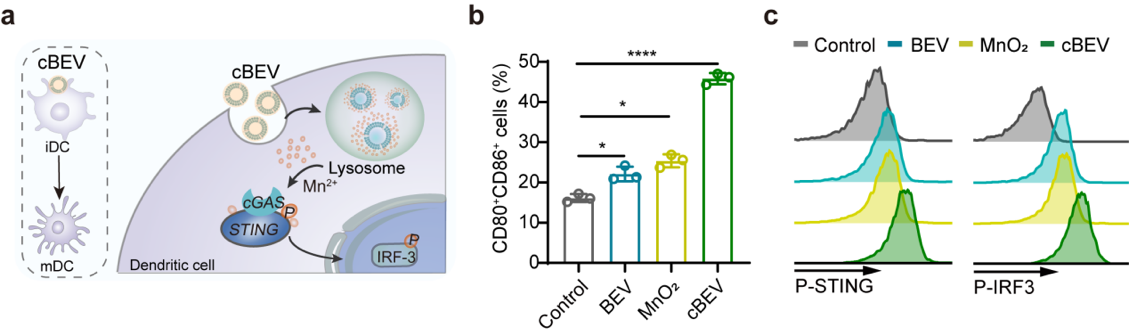 图 3. cBEV通过激活STING通路促进DC成熟(a)cBEV介导的DC成熟示意图。cBEV被BMDCs摄取后,胞浆中释放的游离Mn2+可使cGAS对细菌来源的胞质dsDNA敏感,促进STING通路的激活和DC成熟。(b)不同材料处理后DC成熟相关的蛋白的表达。(c)流式分析STING通路激活相关的蛋白(P-STING, P-IRF3)的表达。图 4. cBEV联合PD-L1抗体协同抑制MCF-7肿瘤生长(a)MCF-7-Luc荷瘤的小鼠治疗后的体内生物发光图像。(b)不同组治疗后小鼠肿瘤生长曲线。文章的创新性包括:1.基于乳腺癌患者富含共生细菌的临床观察,提出这些细菌可以作为改善癌症治疗的有吸引力的分子靶标;2. 为了解决直接利用体内抗菌策略所面临的问题,开发了一种通过封装细菌来源囊泡的响应式纳米斗篷的响应性生物界面。该设计不仅有利于降低细菌源抗原的直接暴露,还能响应胞内环境放大免疫原性,增强免疫响应。Programmed Nanocloak of Commensal Bacteria-Derived Nanovesicles Amplify Strong Immunoreactivity against Tumor Growth and Metastatic Progression. ACS Nano. 2024 Mar 19. doi: 10.1021/acsnano.3c13194.
图 3. cBEV通过激活STING通路促进DC成熟(a)cBEV介导的DC成熟示意图。cBEV被BMDCs摄取后,胞浆中释放的游离Mn2+可使cGAS对细菌来源的胞质dsDNA敏感,促进STING通路的激活和DC成熟。(b)不同材料处理后DC成熟相关的蛋白的表达。(c)流式分析STING通路激活相关的蛋白(P-STING, P-IRF3)的表达。图 4. cBEV联合PD-L1抗体协同抑制MCF-7肿瘤生长(a)MCF-7-Luc荷瘤的小鼠治疗后的体内生物发光图像。(b)不同组治疗后小鼠肿瘤生长曲线。文章的创新性包括:1.基于乳腺癌患者富含共生细菌的临床观察,提出这些细菌可以作为改善癌症治疗的有吸引力的分子靶标;2. 为了解决直接利用体内抗菌策略所面临的问题,开发了一种通过封装细菌来源囊泡的响应式纳米斗篷的响应性生物界面。该设计不仅有利于降低细菌源抗原的直接暴露,还能响应胞内环境放大免疫原性,增强免疫响应。Programmed Nanocloak of Commensal Bacteria-Derived Nanovesicles Amplify Strong Immunoreactivity against Tumor Growth and Metastatic Progression. ACS Nano. 2024 Mar 19. doi: 10.1021/acsnano.3c13194.
外泌体资讯网 ACS Nano | 南京邮电大学汪联辉和丁显光教授团队:基于微流控芯片的细菌来源囊泡工程化诱导强大抗肿瘤免疫反应
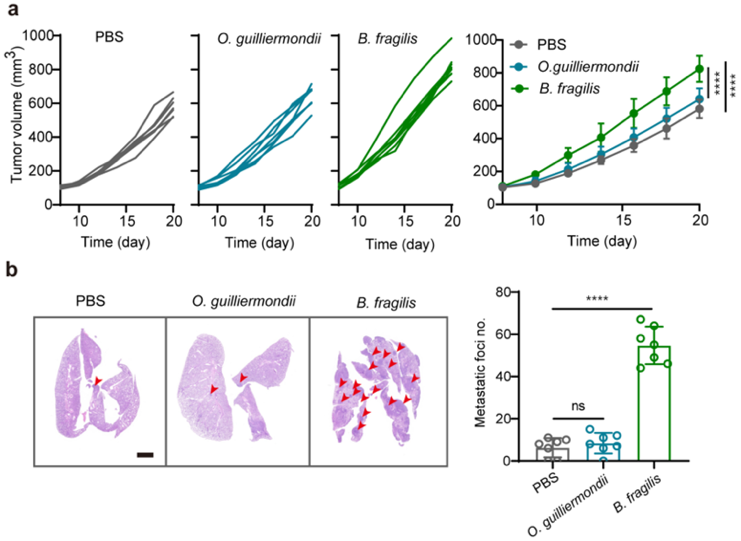
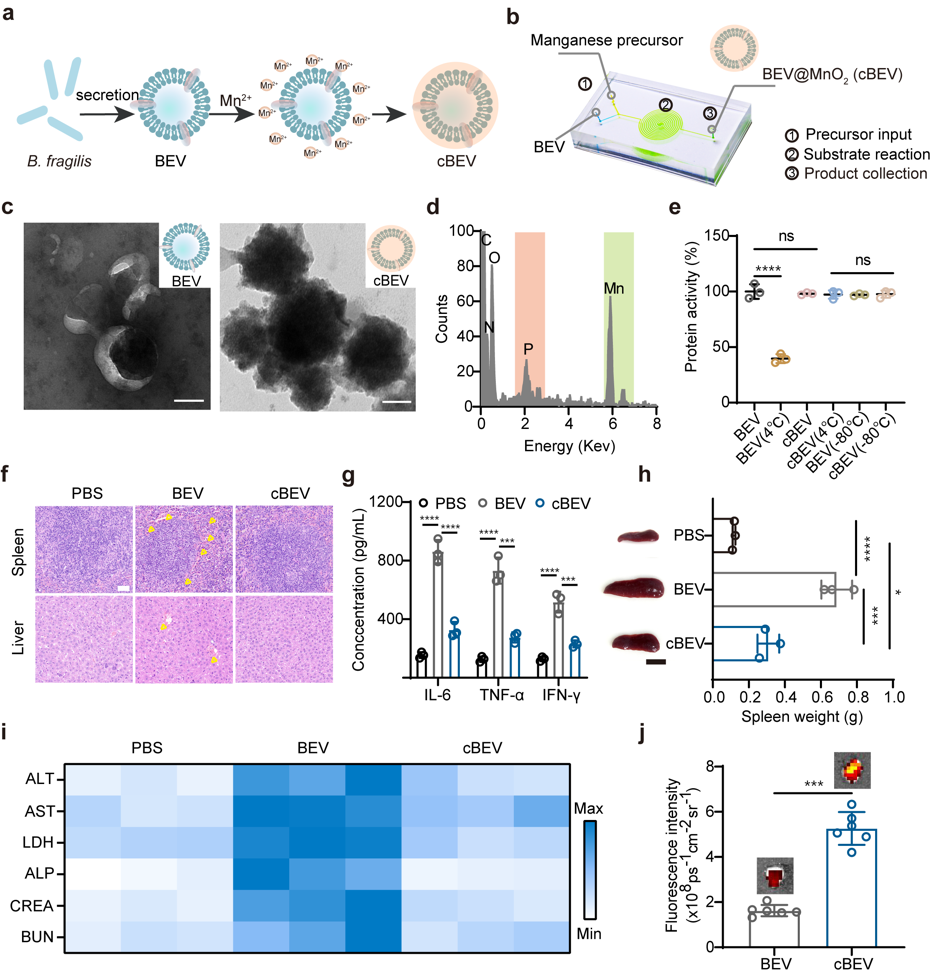
 图 3. cBEV通过激活STING通路促进DC成熟
图 3. cBEV通过激活STING通路促进DC成熟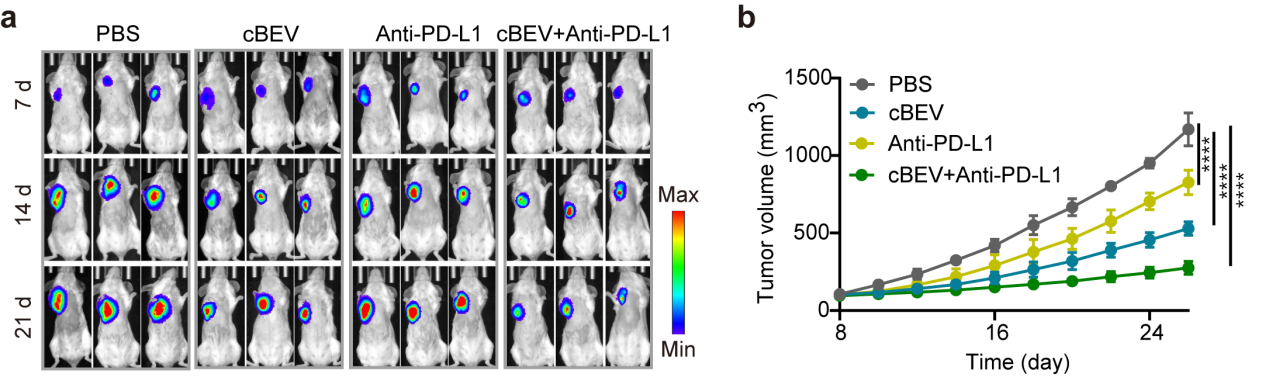


 图 3. cBEV通过激活STING通路促进DC成熟
图 3. cBEV通过激活STING通路促进DC成熟