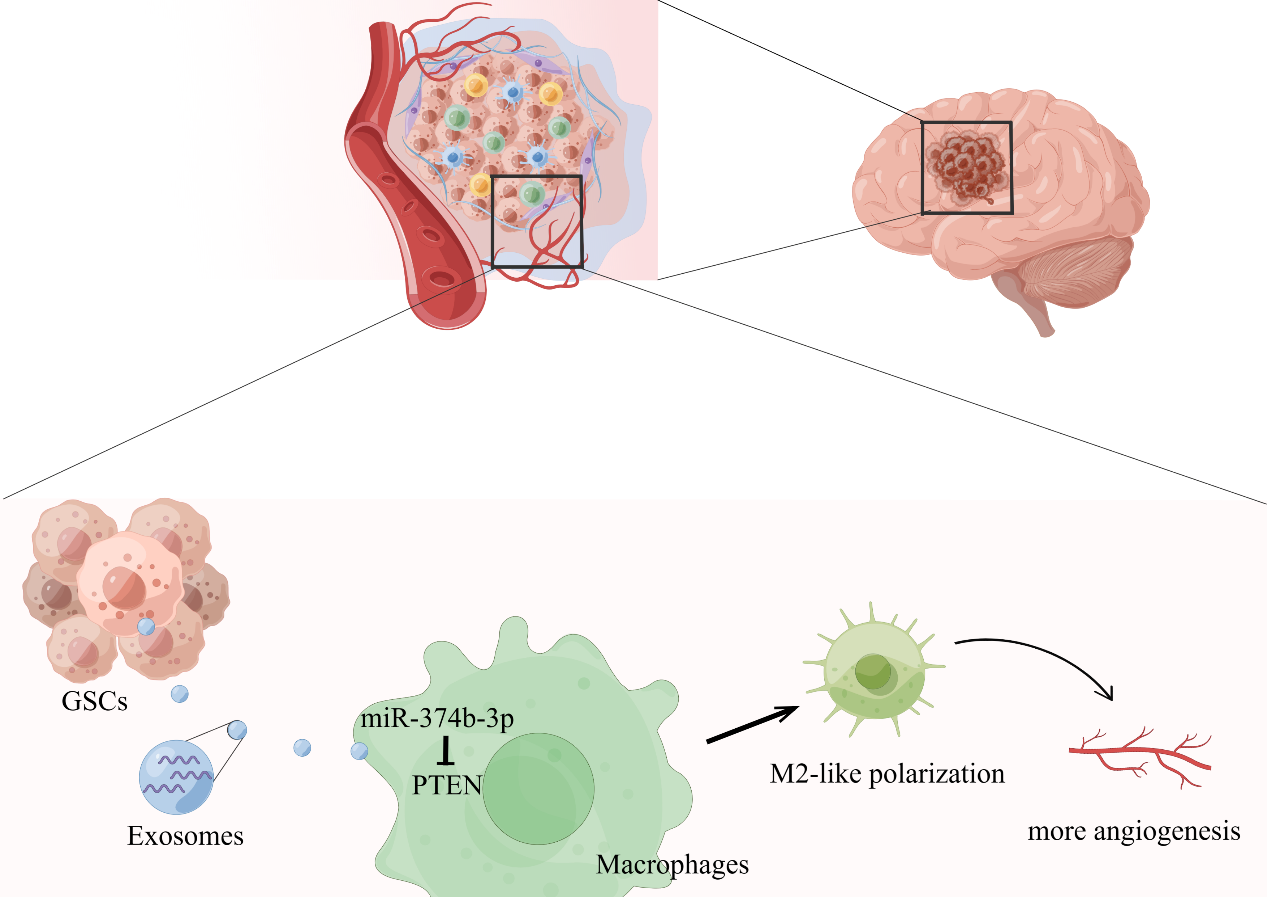
胶质母细胞瘤是中枢神经系统中最致命的癌症。肿瘤的发展往往伴随大量新的血管生成来维持肿瘤细胞的生长和增殖。胶质瘤干细胞(GSCs)重构的肿瘤微环境在胶质母细胞瘤发生及恶性进展中发挥着重要的作用。其中肿瘤相关巨噬细胞(TAMs)是除GSCs及其繁衍的胶质瘤细胞外占比最高的微环境细胞,约占肿瘤组织中全部细胞的5-15%。TAMs的极化对肿瘤血管新生发挥着重要的调节作用。因此,深入了解GSCs 、TAMs与血管内皮之间的调控机制及关键靶分子,可为胶质瘤治疗新策略提供新思路。近日,苏州大学附属第二医院神经外科董军教授团队在iScience(中科院二区)上发表了题为“Glioblastoma stem cell-derived exosomal miR-374b-3p promotes tumor angiogenesis and progression through inducing M2 macrophages polarization”的研究论文(2024 Feb 22;27(3):109270),该研究揭示了GSCs分泌的外泌体miR-374b-3p诱导巨噬细胞M2型极化,进一步提高了血管内皮细胞的迁移与血管形成能力。苏州大学附属第二医院神经外科董军教授为文章的通讯作者。
该研究确定了GSCs及其分泌的外泌体能诱导巨噬细胞M2型极化,极化后的M2巨噬细胞进一步提高了血管内皮细胞的迁移与血管形成能力。鉴于外泌体已被证明可以运输miRNAs调控受体细胞功能,研究发现miR-374b-3p在胶质母细胞瘤患者的手术标本中富集,在GSCs衍生的外泌体中高度表达,并通过外泌体递送至巨噬细胞靶向PTEN从而介导M2型巨噬细胞的极化。这些数据表明,GSCs产生富含miR-374b-3p的外泌体,诱导巨噬细胞的M2型极化,以增强血管内皮细胞的迁移与血管形成能力。靶向外泌体miR-374b-3p可能提供一个潜在的对抗胶质母细胞瘤的新策略。胶质瘤研究有一个共同问题是荷瘤鼠缺乏T淋巴细胞,这限制了对免疫相关实验数据的解释,巨噬细胞在GSCs免疫微环境中的作用将在人源化肿瘤模型进一步阐明。图1(由Figdraw绘制):GSCs外泌体miR-374b-3p诱导巨噬细胞M2极化,进而促进血管内皮细胞的迁移与血管形成能力该研究发现GSCs促进血管生成的一种新机制,即经过GSCs分泌外泌体miR-374b-3p重塑的TAMs来促进血管内皮细胞的迁移与血管形成能力,因此针对这一分子调控机制有潜力作为对抗GBM化疗抵抗的新策略。Glioblastoma stem cell-derived exosomal miR-374b-3p promotes tumor angiogenesis and progression through inducing M2 macrophages polarization. iScience. 2024 Feb 22;27(3):109270. doi: 10.1016/j.isci.2024.109270. eCollection 2024 Mar 15.外泌体资讯网 iScience︱苏州大学董军团队发现胶质瘤干细胞调控血管生成新机制