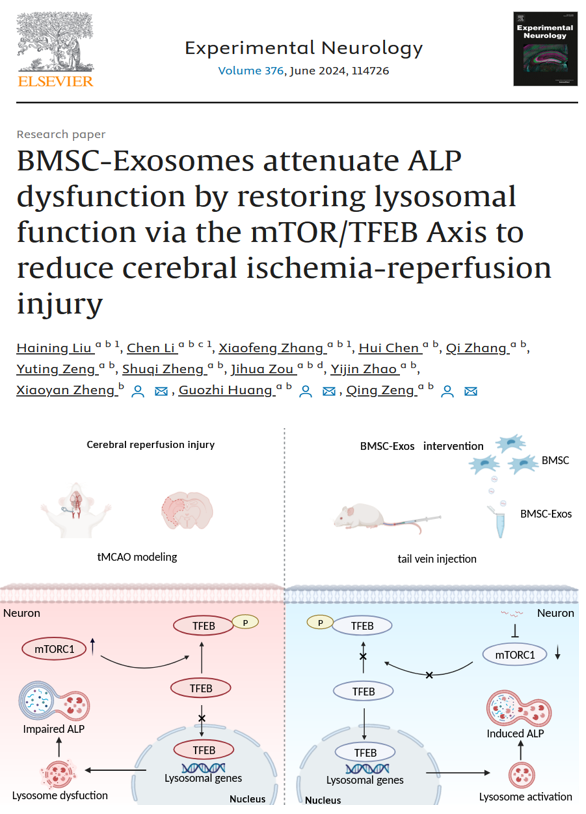
脑缺血再灌注损伤(Cerebral Ischemia/Reperfusion injury,CIRI)后病理生理过程十分复杂,其中错误折叠蛋白质以及损伤细胞器的积累是导致神经元死亡的重要原因,而自噬溶酶体通路(the autophagy-lysosomal pathway,ALP)是神经元清除长期错误折叠蛋白质、损伤细胞器从而维持细胞稳态的重要途径。
近日,来自南方医科大学珠江医院的研究人员报道了骨髓间充质干细胞(BMSC)分泌的外泌体通过mTOR/TFEB通路恢复溶酶体功能进而减轻脑缺血再灌注后ALP功能障碍(机制图见图1)的研究成果。并以“BMSC-Exosomes attenuate ALP dysfunction by restoring lysosomal function via the mTOR/TFEB Axis to reduce cerebral ischemia-reperfusion injury”为题发表在了Experimental Neurology上(2024 Feb 23:376:114726. PMID: 38403042) 南方医科大学珠江医院康复医学科刘海宁硕士、李琛博士和张晓锋硕士为该文章的共同第一作者,南方医科大学珠江医院康复医学科黄国志教授、曾庆副教授和南方医科大学康复医学院郑晓燕老师为该文的通讯作者。
图1 机制图
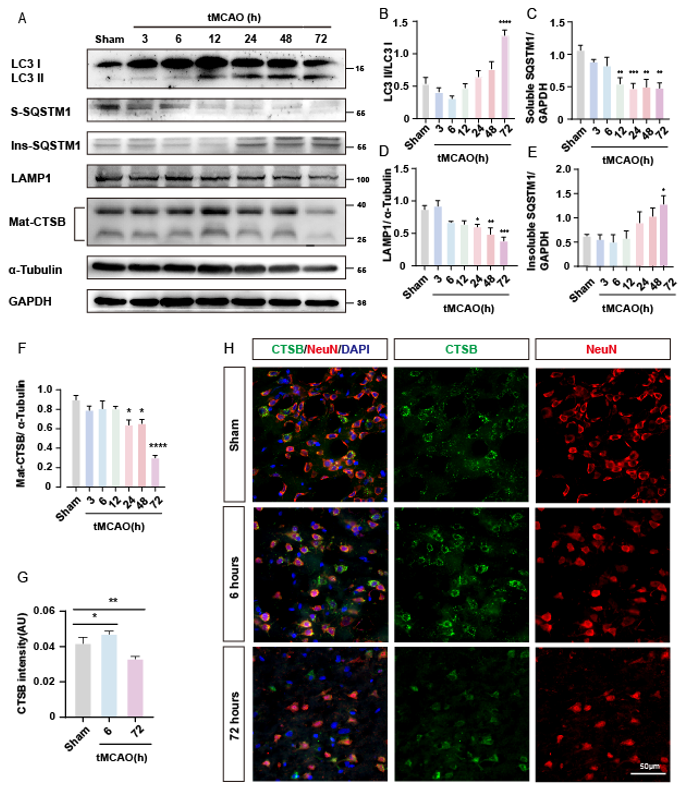
为验证tMCAO后是否发生ALP功能障碍及其在不同时间点的状态,研究团队分别建立Sham组和tMCAO后3h、6h、12h、24h、48h、72h组。使用Western blots检测自噬流及溶酶体相关蛋白的表达变化,研究表明72h组LC3 II/LC3 I表达增加(图2A, B),提示可能存在自噬体聚集。此外,与Sham组相比,可溶性SQSTM1表达在12、24、48和72h组显著降低(图2A, C),而不溶性SQSTM1表达在72h组较Sham组增加(图21, E),以上提示tMCAO后72h发生自噬流阻断。同时,溶酶体相关膜蛋白1 (LAMP1)的表达在72h时降低(图2A, D),而mat-CTSB(组织蛋白酶B)的表达在24、48和72h时显著降低(图2A, F)。这两个指标提示,tMCAO后72h可能发生溶酶体功能障碍。另外,采用免疫荧光染色法检测CTSB的荧光强度。免疫荧光结果显示,与Sham组相比,6h组CTSB荧光强度升高,72h组CTSB荧光强度降低。
图2. 脑缺血再灌注后72h发生ALP功能障碍
为了评估脑缺血再灌注后自噬溶酶体通路相关蛋白的改变,研究者处死tMCAO大鼠,并在tMCAO后3、6、12、24、48、72 h取下tMCAO大鼠脑组织皮层缺血半暗带区域。(A) Western blots的代表性图像。自噬溶酶体相关蛋白灰度值的印迹检测。(B-F)相关蛋白的灰度值统计:LC3 II/LC3 I,可溶性SQSTM1,不溶性SQSTM1,溶酶体蛋白LAMP1和CTSB。(G) CTSB荧光强度半定量。(H) tMCAO大鼠脑皮质缺血半暗带代表性免疫荧光染色照片。
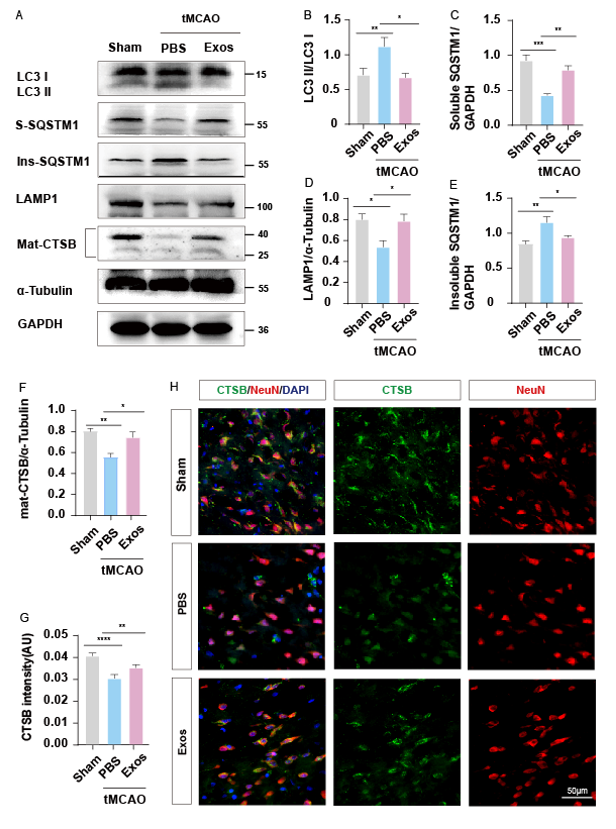
有广泛研究证实外泌体可以通过调控自噬改善多种疾病,但目前还未有研究报道骨髓间充质干细胞来源的外泌体(Bone Mesenchymal Stem Cells-Exosomes, BMSC-Exos)在 CIRI 后 ALP 功能障碍中的调控作用。本研究团队为了验证BMSC-Exos是否可以通过恢复溶酶体功能来减轻ALP功能障碍,检测了BMSC-Exos干预后tMCAO 72小时的自噬流和溶酶体相关蛋白。Western blot结果发现与PBS组相比,Exos组LC3 II/LC3 I的表达降低(图3A, B)。此外,Exos组可溶性SQSTM1的表达比PBS组增加(图3A, C)。同时,Exos组不溶性SQSTM1的表达比PBS组降低(图3A, C,E).这三个指标的变化表明BMSC-Exos可以促进自噬流。进一步的溶酶体相关蛋白检测显示,与PBS组相比,Exos组LAMP1和CTSB的表达增加(图,3A, D, F)。同时,采用免疫荧光染色法检测CTSB的荧光强度。结果显示,Exos组的CTSB荧光强度高于PBS组(图3G, H),结合Western blot结果推测,BMSC-Exos可以改善溶酶体功能障碍。
图3 BMSC-Exos可减轻tMCAO后72小时发生的自噬溶酶体功能障碍
为了评估tMCAO和BMSC-Exos干预后自噬溶酶体途径相关蛋白的改变,我们建立了三个实验组,并在tMCAO 72h后获得了tMCAO大鼠大脑皮层缺血半暗带。(A)外泌体干预后自噬-溶酶体途径相关蛋白的代表性条带的Western blot。(B-F)相关蛋白的灰度值统计,n=6。(G) CTSB荧光强度半定量。(H) tMCAO大鼠脑皮质缺血半暗区代表性双免疫荧光染色照。
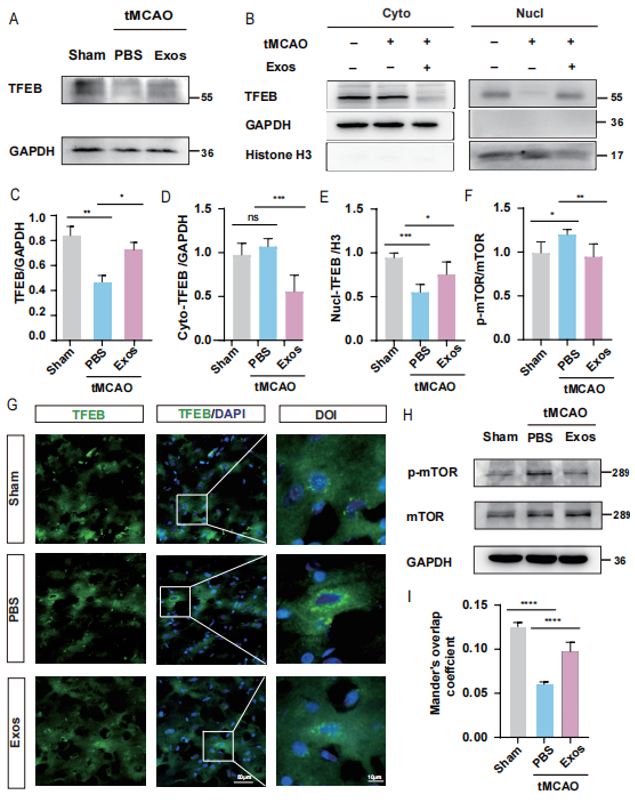
为了进一步探究BMSC-Exos干预后,TFEB入核情况,研究团队提取了组织细胞核及细胞质蛋白,采用Western blotting及免疫荧光染色检测了tMCAO大鼠脑皮质缺血半暗带区域中TFEB表达。Western blot结果显示,与Sham组相比,PBS组细胞核中TFEB的表达明显降低,而加入BMSC-Exos后细胞核中TFEB的表达增加(图4B, D-F)。同时,为了确定BMSC-Exos对mTOR和p-mTOR水平的影响,采用Western blotting检测发现BMSC-Exos具有抑制mTOR表达的作用(图4F, H)。
图4 BMSC-Exos可促进TFEB入核,抑制mTOR表达
(A)总TFEB的代表性蛋白条带的Western blot。(B)用试剂盒提取和分离tMCAO大鼠大脑皮质缺血半暗区细胞质和细胞核蛋白,Western blot检测代表性蛋白条带。(C-F)相关蛋白的灰度值统计;C和F, n=6;D,E, n = 5。(G)免疫荧光染色图片和基于DAPI的TFEB共定位观察,观察细胞核内的TFEB。(H)代表性mTOR和p-mTOR蛋白条带的Western blot检测。(I) tMCAO大鼠脑皮质缺血半暗带免疫印迹蛋白定量。
为了进一步评估BMSC-Exos是否可以通过抑制mTOR促进TFEB入核进而恢复溶酶体功能来减轻ALP功能障碍,研究团队进一步在体外建立了PC12细胞的细胞缺氧/复氧(OGD/R)模型,进一步验证 BMSC-Exos 干预对于 OGD/R 后 PC12 细胞存活率的影响,以及使用MHY1485(mTOR 激动剂)、Rapamycin(mTOR 抑制剂)后对其存活率的影响。研究发现, mTOR的激活剂—MHY1485的使用逆转了BMSC-Exos对OGD/R后PC12细胞的保护作用,而mTOR抑制剂—雷帕霉素组显示出与Exos组相似的作用效果。与此同时,本研究团队进一步评估了mTOR激动剂以及抑制剂干预后对TFEB入核的影响。Western blot结果发现,BMSC-Exos可以激活OGD/R后PC12细胞的TFEB入核,而MHY1485可以逆转BMSC-Exos激活TFEB入核的作用。最后,雷帕霉素组显示了与Exos组相同的结果(图5D, E, G)。同时,采用免疫荧光对溶酶体Marker—CTSB进行染色。结果发现,Exos组的CTSB荧光强度高于OGD/R组。此外,MHY1485的加入减弱了CTSB的免疫荧光强度,从而逆转了BMSC-Exos的作用,雷帕霉素组CTSB的免疫荧光强度提高,其效果与BMSC-Exos相似(图5F, H)。
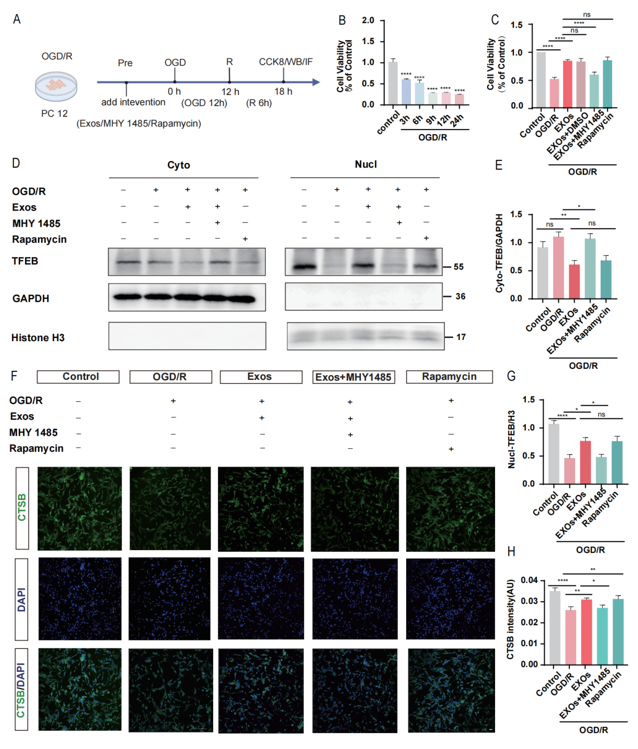
图5 BMSC-Exos可以通过抑制mTOR促进TFEB入核
为了评估BMSC-Exos是否通过抑制mTOR改善ALP.(A)体外实验模式图。(B)不同复氧时间后CCK8检测细胞存活率,n=3。(C) CCK8检测各组细胞存活率,n=4。(D)不同组细胞质和细胞核中TFEB代表性蛋白带的Western blots。(E)相关蛋白的灰度值统计,n=4。(F)免疫荧光染色图。(H) CTSB蛋白半定量,n=4。所有数据均以均数±SEM表示,p * <0.05, p * * < 0.01, p * * *< 0.001, p < 0.0001。
参考文献:
BMSC-Exosomes attenuate ALP dysfunction by restoring lysosomal function via the mTOR/TFEB Axis to reduce cerebral ischemia-reperfusion injury. Exp Neurol. 2024 Feb 23;376:114726. doi: 10.1016/j.expneurol.2024.114726.
外泌体资讯网 Exp Neurol | 南方医科大学珠江医院:BMSC外泌体恢复溶酶体功能减轻脑缺血再灌注损伤,从而减轻ALP功能障碍