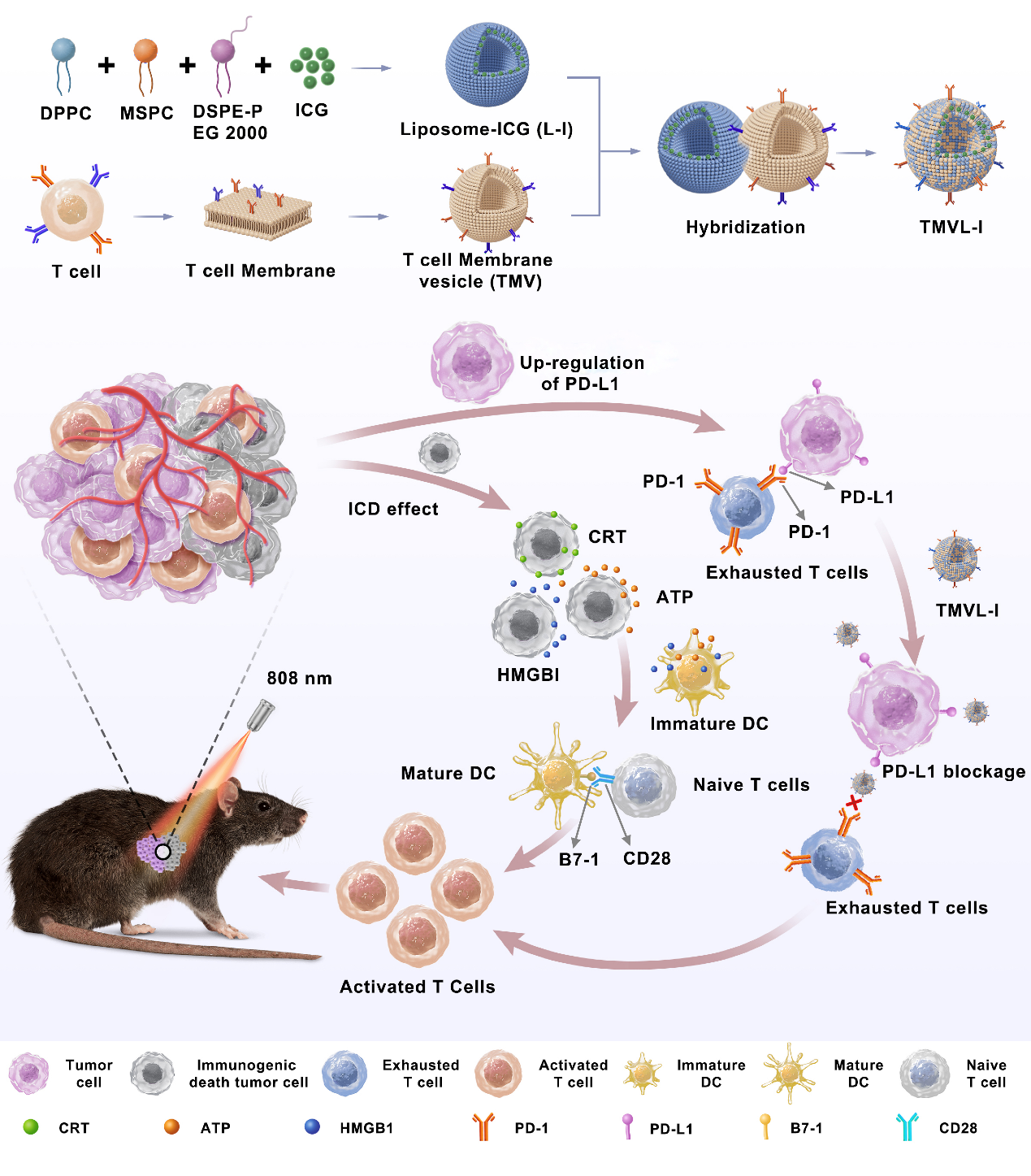
激活肿瘤免疫微环境的免疫响应已经成为治疗肿瘤的有效策略。其中诱导肿瘤细胞发生免疫原性细胞死亡(ICD)可以激活强大的免疫反应,并在多种肿瘤中显示出良好的临床治疗效果。它通过释放损伤相关分子模式(DAMPs)和肿瘤相关抗原(TAAs)刺激树突状细胞(DC)的成熟,增强其向T细胞的抗原呈递,可以显著激活抗肿瘤免疫反应。 然而,ICD的作用经常受到免疫抑制通路的损害,如程序性细胞死亡配体1(PD-L1)介导的相关通路。ICD效应会增加干扰素(IFN)的释放,并通过激活JAK/STAT途径诱导PD-L1的上调,导致肿瘤细胞的免疫逃逸和T细胞功能的抑制。此外,多种药物的共同给药会增加药物递送载体设计的复杂性和细胞毒性,进一步增加临床应用的难度和不确定性。因此,具有自身免疫抑制阻断作用的载体对于增强ICD的免疫反应至关重要。
近日,国家纳米科学中心杨延莲研究员、朱凌研究员、王琛研究员在Nano Today发表题为“T lymphocyte-derived immunogenic hybrid nanovesicles for immunosuppression reversion and boosted photothermal immunotherapy“的研究论文(10.1016/j.nantod.2024.102148)。
这项工作中,作者基于程序性细胞死亡蛋白1(PD-1)在T淋巴细胞中的高表达,开发了一种免疫原性光热融合纳米囊泡,以增强光热治疗(PTT)诱导的ICD效应,扭转免疫抑制的肿瘤微环境。融合囊泡(TMVL-I)由高表达PD-1的T细胞衍生膜囊泡(TMLV)和负载吲哚菁绿(ICG)的热敏脂质体(L-I)的通过磷脂双分子层融合构建。TMVL-I可以与肿瘤细胞表面上调的PD-L1结合,有效阻断CTL与肿瘤细胞之间的PD-1/PD-L1通路,从而逆转肿瘤免疫抑制,增强光热诱导的ICD效应。这一策略显著诱导DC的成熟,增强CTL对原发性和远端肿瘤的浸润以及脾脏CTL的激活,显著抑制B16肿瘤的生长,并提高B16荷瘤小鼠的存活率。这项工作提出了一种通用的T细胞衍生囊泡的融合囊泡,并为基于免疫抑制微环境重塑的联合治疗提供了一种可行的策略。
示意图. TMVL-I的制备过程以及TMVL-I通过PTT和PD-L1阻断联合抗肿瘤机制。
国家纳米科学中心刘静怡博士为文章的第一作者。国家纳米科学中心杨延莲研究员、朱凌研究员、王琛研究员为共同通讯作者。
参考文献:
T lymphocyte-derived immunogenic hybrid nanovesicles for immunosuppression reversion and boosted photothermal immunotherapy, Nano Today, 55 (2024), 102148.
https://doi.org/10.1016/j.nantod.2024.102148.
供稿:刘静怡
外泌体资讯网 Nano Today|国家纳米科学中心杨延莲/朱凌/王琛:T淋巴细胞来源免疫原性融合纳米囊泡用于免疫抑制逆转和增强的光热免疫疗法