胰腺导管腺癌(PDAC)的早期阶段检测、或者预测正在接受化疗的晚期患者的预后是具有挑战性的。而特定致癌基因的激活会使血液中循环的细胞外囊泡(EVs)中mRNA及其相应的蛋白质表达升高,如Glypicans-1(GPC1)。基于以上原理,来自美国俄亥俄州立大学的研究人员利用一种免疫脂质体纳米颗粒(ILN)生物芯片检测法,发现GPC1 mRNA在富含外泌体(Exo)的EV亚群中高表达,并且GPC1膜蛋白(mProtein)在富含肿瘤相关微囊泡(tMV)的EV亚群中的表达,可以作为PDAC的可行生物标志物。利用该标志物,研究有效筛查了早期PDAC患者,并预测了接受化疗的晚期PDAC患者的预后。相关内容以“Extracellular Vesicular Analysis of Glypican 1 mRNA and Protein for Pancreatic Cancer Diagnosis and Prognosis”为题在线发表于1月10日的国际知名综合性期刊Advanced Science上。
胰腺癌表现出异常低的5年生存率,不足10%,其中胰腺导管腺癌(PDAC)是最常见的类型之一。与胰腺癌相关的高死亡率部分归因于早期检测方法的缺失。早期胰腺癌患者所表现出来的症状有限,而常规的影像技术如X光和CT扫描通常缺乏所需的敏感性和确定性。另一方面,组织活检是侵入性的,有时由于肿瘤位置隐蔽而具有挑战性。目前,临床实践中PDAC的主要分子诊断方法涉及评估基于血液的蛋白质生物标志物,如CA19-9。然而,缺乏Lewis血型抗原基因型的PDAC患者无法在恶性组织存在的情况下产生CA19-9抗原。此外,具有Lewis抗原基因型的患者CA19-9的产生水平可能有所变化。CA19-9表达的异质性是为什么基于CA19-9的连续测量只能帮助一部分PDAC患者的原因。
在PDAC肿瘤组织中,诸如KRAS和TP53等突变的驱动基因及其翻译的蛋白质可以在癌细胞中识别和测量。虽然高度特异性,但由于获取程序的侵入性,从PDAC患者获取肿瘤组织存在挑战。循环肿瘤细胞(CTCs)和循环肿瘤DNA(ctDNA)正在作为癌症诊断的液体生物标志物进行研究,但它们在血液中的低浓度和检测的高成本引起了有关它们在早期癌症筛查和治疗预后中的临床效用的担忧。细胞外RNA和蛋白质在血液和其他体液中表现出稳定性,部分原因是它们封装在细胞分泌的细胞外囊泡(EVs)中,如外泌体和微囊泡。捕获EVs并量化感兴趣的封闭RNA和蛋白质成为了在癌症检测中开发非侵入性检测方法的有望策略。
糖蛋白Glypicans是通过一种糖基磷脂酰肌醇链接固定在外部质膜上的肝素硫酸蛋白聚糖。它们的主要作用涉及调节Wnts、Hedgehogs、成纤维细胞生长因子和骨形态发生蛋白信号通路。Glypicans-1(GPC1)在多种癌症类型中表达明显升高,包括PDAC、乳腺癌、食管鳞状细胞癌、胶质母细胞瘤、结直肠癌、肝细胞癌和宫颈癌。转染GPC1 RNAi已经表明在培养的结肠癌细胞中阻碍有丝分裂反应,从而将GPC1确立为癌症检测的潜在生物标志物。
外泌体GPC1蛋白在早期和晚期PDAC患者的检测中表现出希望。然而,复制这些高特异性和敏感性一直是非常困难的。研究团队通过在阳离子脂质-聚合物混合纳米颗粒(LPHNs)中使用一个发卡DNA电路,确立了外泌体GPC1 mRNA作为早期PDAC检测的优越生物标志物。然而,这种技术的挑战在于精确地封装实现信号放大所需的四个组分在纳米大小的LPHNs内。此外,Melo等人的外泌体GPC1蛋白研究和该团队先前研究中的GPC1 mRNA检测都采用了耗时的超速离心法进行EV分离,这在临床应用中并不实际。
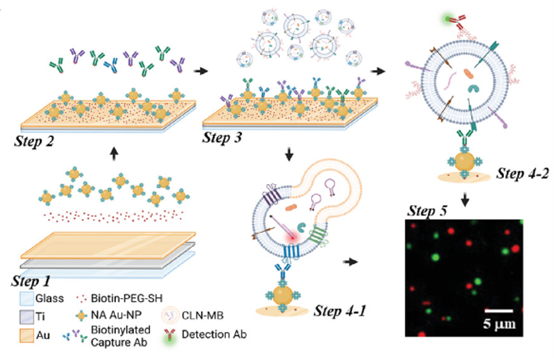
因此,研究人员引入了一种设计用于捕获特定EV亚群并在单个EV水平上检测GPC1 mRNA及其相应的翻译蛋白质的免疫脂质体纳米颗粒(ILN)生物芯片检测法。为了从液体样本中分离EVs,研究人员采用了快速、简便且商业可获得的EV分离试剂盒。研究表明,使用CD63/CD9/CD81抗体的组合捕获的外泌体(Exo)主导的EV亚群在基于mRNA的癌症标志物方面表现出有效性。相反,通过一系列抗体靶向癌细胞表面富含抗原的方式捕获的肿瘤相关微囊泡(tMV)被确定为适合作为基于膜蛋白(mProtein)的癌症标志物。
通过ILN生物芯片检测法,研究人员成功验证了GPC1 Exo-mRNA/GPC1 tMV-mProtein生物标志物概念用于PDAC。为了评估ILN生物芯片检测法和GPC1 Exo-mRNA/tMV-mProtein在早期PDAC筛查和治疗预后中的转化潜力,研究人员使用了大量临床患者样本进行了全面评估。此外,研究人员将EV-GPC1生物标志物性能与CA19-9水平进行了比较,CA19-9是PDAC诊断和预后的已建立的临床标准生物标志物。在血液中, GPC1 Exo-mRNA/GPC1 tMV-mProtein表达与CA19-9水平一起结合,有效区分了早期和晚期PDAC患者、健康供体和良性胰腺疾病(BPD)。此外, EV分析显示了在化疗前GPC1 Exo-mRNA/GPC1 tMV-mProtein表达与晚期PDAC患者的整体生存之间存在强烈的相关性。通过测量血液中的CA19-9水平无法实现这种相关性,表明这种检测方法的预后判断潜力。因此,该研究强调了细胞外囊泡中GPC1表达在早期PDAC筛查和化疗预后中的预测潜力。
参考文献:Extracellular Vesicular Analysis of Glypican 1 mRNA and Protein for Pancreatic Cancer Diagnosis and Prognosis. Adv Sci (Weinh), 2024. Doi:10.1002/advs.202306373.