作为细胞间通讯的关键介质,细胞外囊泡(EVs)一直在积极探索用于诊断和治疗的应用。然而,目前仍然缺乏有效的方法来功能化EVs并调节EVs与受体细胞之间的相互作用。来自美国伊利诺伊大学厄本那香槟分校的研究人员报告了一种简便而普遍的代谢标记EVs技术,可以在EVs上安装独特的化学标记物。这些表面化学标记通过高效的点击化学反应,使分子能够结合到EVs上,实现对EVs的跟踪和有针对性的调节。进一步,研究人员通过在EVs表面修饰Toll样受体激动剂,引发了抗肿瘤免疫反应,实现了有效的肿瘤疫苗增强效果。相关内容以“Metabolic tagging of extracellular vesicles and development of enhanced extracellular vesicle based cancer vaccines”为题在线发表于12月5日的国际综合性学术期刊Nature Communications上。
细胞外囊泡(EVs)包含了各种细胞内含物,并在细胞间通讯中发挥着至关重要的作用。目前,大量研究集中于发现EVs在不同疾病中的作用,以及探索它们在诊断和治疗中的应用。为了实现EVs的诊断治疗应用目的,需要对EVs进行功能化,用于进行示踪和靶向治疗。由于细胞膜上表达的蛋白质密度通常在每个细胞中处于10的3-6次方的范围内,而基因表达方法可能潜在地向母细胞增加高达10的6次方个蛋白质,但只有少量蛋白质会被细胞分泌的EVs继承(细胞和EV之间存在10,000倍的表面积差异),这还是在不考虑基因转染的复杂性和变化的效率的情况下。原则上,EVs也可能携带从母细胞继承而来的含氨基蛋白,以便使用含氨基羧基化学反应进行表面功能化,但每个EV上的表面氨基基团数量可能很少。
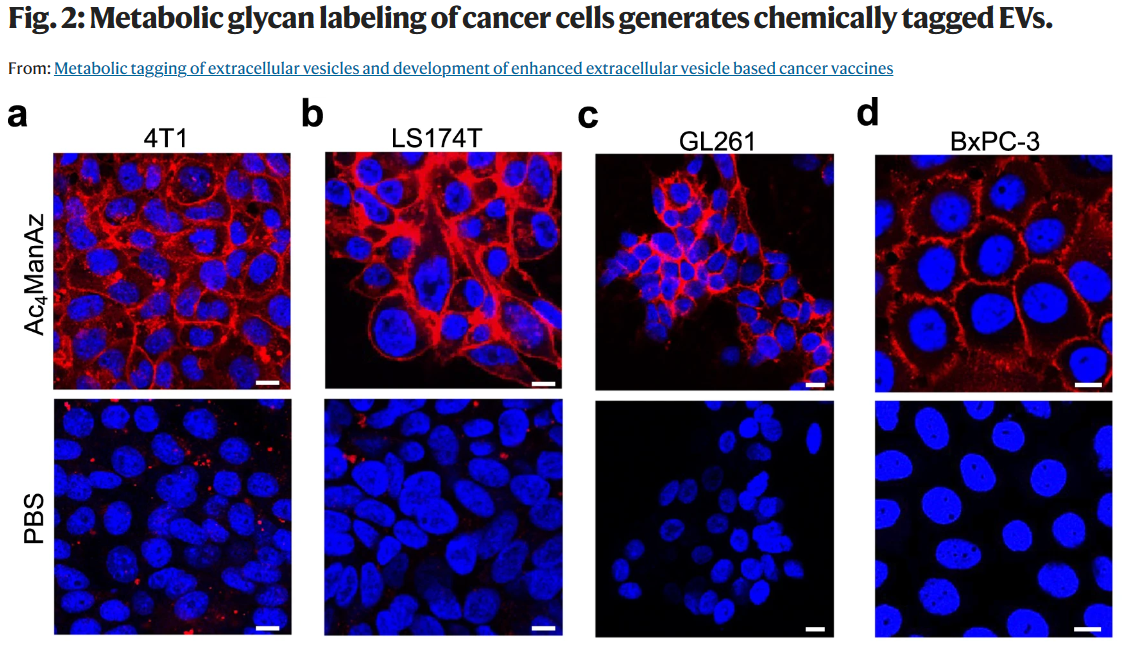
在这项研究里,研究人员展示通过对母细胞进行代谢糖链的标记,可以在每个细胞的膜上引入10的8-9次方个化学标记物(例如偶联基团),形成糖蛋白和糖脂的形式,从而产生化学标记的EVs(如图所示)。这种EV标记方法普遍适用于各种类型的癌细胞、间充质干细胞(MSCs)、树突状细胞(DCs)和T细胞分泌的EVs。表面化学标记使EVs能够在体外和体内进行跟踪和靶向治疗,并通过高效的“点击化学”进行分子的表面结合和展示。
EVs的一个重要作用是在细胞之间传递分子信号,而受体细胞对EVs的处理是一个关键步骤。例如,肿瘤EVs可以被抗原呈递细胞(例如树突状细胞DCs)内吞,随后由DCs处理和呈递封装的抗原,以随后引导特异性T细胞的抗原启动。与传统使用的死亡肿瘤细胞或肿瘤裂解物相比,肿瘤EVs被视为一种更安全的肿瘤抗原来源,已经在临床试验中表现出诱导抗肿瘤细胞毒性T淋巴细胞(CTL)反应的能力。然而,由于EVs中肿瘤抗原的丰度较低以及DCs对EV封装的抗原进行处理和呈递的激活不足,由此产生的CTL反应和治疗效果仍然较为有限。
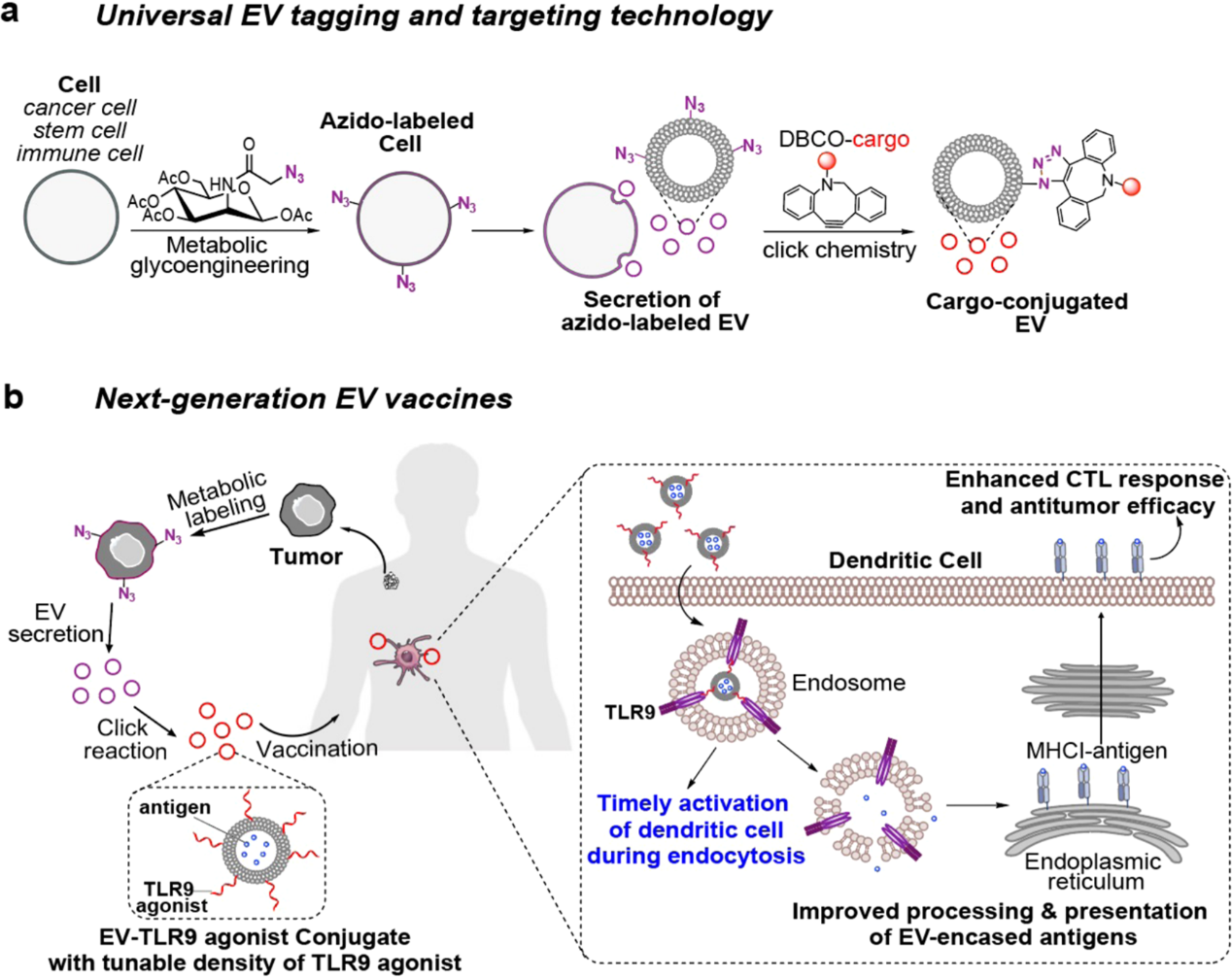
图:细胞外囊泡的代谢标记和靶向以及其用于下一代细胞外囊泡疫苗的开发。A. 细胞可以通过代谢性糖链取代过程使用化学标记(偶联基团如偶氮基)进行代谢标记,从而在随后分泌带有偶氮标记的细胞外囊泡(EVs)。然后,带有偶氮标记的EVs可以通过高效的生物正交点击化学反应介导DBCO-载体的结合,用于体外和体内跟踪和靶向EVs。B. 通过协调EVs与DCs之间的相互作用来开发下一代EV疫苗。来自患者的细胞(例如肿瘤细胞)可以通过代谢性标记分泌带有偶氮标记的EVs,以随后通过点击化学反应结合TLR9激动剂。在体内给药后,TLR9激动剂结合的EVs可以通过内体被DCs内吞,内体中存在TLR9。EVs表面的TLR9激动剂与内体中TLR9的结合可以及时刺激DCs,可以实现增强的CTL反应和抗肿瘤效果。
实际上,肿瘤EVs本身可能阻碍DCs的成熟。用于激活DCs的佐剂(例如氢氧化铝)的引入已经成为改进传统疫苗的标准做法。然而,简单与佐剂混合未能显著增强肿瘤EV疫苗的抗肿瘤效果。这些问题促使研究人员开发新的方法,能够很好地整合肿瘤EVs和佐剂,以最佳方式调节DCs并引发CTL反应。
因此,研究人员设想,通过已经完成的代谢标记EVs和靶向方法,能够在EVs表面定量结合和展示大量分子的能力,将使EVs与受体细胞之间的相互作用协调起来。由于EVs通过内体被DCs内吞,而内体中存在Toll样受体TLR3、TLR7、TLR8和TLR9,所以在EVs表面展示足够的TLR3/7/8/9激动剂可能可以及时刺激内体表面的TLRs,从而改善DCs在内吞肿瘤EVs的过程中的激活。因此,EVs封装抗原的处理和呈递以及总体CTL反应和抗肿瘤效果可以得到增强。
研究结果显示,在肿瘤EV疫苗的背景下,研究人员展示了将TLR9激动剂偶联到EVs上,能够及时激活DC细胞并产生优越的抗肿瘤CD8+ T细胞反应。这导致对E.G7淋巴瘤的80%无肿瘤存活率和对B16F10黑色素瘤的33%无肿瘤存活率。该研究提供了一种通用技术,能够从母细胞生成化学标记的EVs,调节EVs与细胞的相互作用,并开发强效的EV疫苗。调节EVs与抗原呈递细胞之间的相互作用的这种能力有望提高肿瘤EV疫苗的治疗效果。
参考文献:Metabolic tagging of extracellular vesicles and development of enhanced extracellular vesicle based cancer vaccines. Nat Commun. 2023;14(1):8047.