肿瘤来源细胞外囊泡(T-EVs)及其内含物被视为有价值的生物标志物,成为癌症早期诊断和治疗评估的理想靶点。然而,由于其他正常细胞,例如血小板也释放EVs,T-EVs在血液中的丰度极低,对T-EVs的富集效率产生了不利影响。另一方面,T-EVs和正常细胞源性EVs在大小、密度、膜蛋白和表面电荷方面差异不大,这必然降低了分离的特异性。因此,有必要开发出从复杂基质中准确分离T-EVs的方法,这是开展相关下游研究的前提。
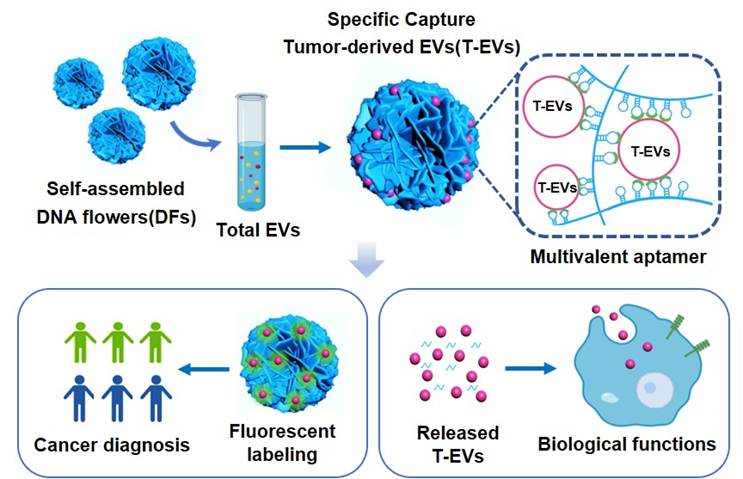
鉴于上述原因,浙江大学化学系姚波,王敏教授联合北大医疗鲁中医院路阳主任发展了一种含有编程重复和等距EpCAM适体的多价DNA纳米花(DFs),用于有效分离T-EVs。DFs中的多价适体链具有良好的柔韧性,能够适应T-EVs的表面形态,实现多价配体与受体的相互作用,因此比单价适体具有更强的结合能力。与其他用于分离EV的材料相比,DFs是通过滚环扩增(RCA)产生并在一锅反应中自组装成微球结构的,识别分子(适配体)在RCA反应中直接复制和组装,而不是在固体材料表面进行化学修饰和固定。此外,作为光学透明的生物材料,EpCAM+ ev的含量可以通过标记DFs@EpCAM+ EV复合物中的磷脂直接反映出来,该团队发现EpCAM+ EV的数量在癌症诊断中的准确性高于总EV(88.3% vs 69.7%),也高于临床常用的标志物CEA(88.3% vs 76.7%)。此外,T-EVs可以通过核酸酶裂解DFs而被释放,并保持高完整性和活性,用于下游生物学功能的研究。这些结果表明,DFs是一种高效、无损的分离、检测和释放T-EVs的工具。相关工作以“Multivalent DNA Flowers for High-Performance Isolation, Detection, and Release of Tumor-Derived Extracellular Vesicles”为题发表在ACS Applied Materials & Interfaces上 (doi.org/10.1021/acsami.3c12211)。
在这项研究工作中,该团队建立了一种多靶标多用途的EVs分离检测新策略。首先,所构建的DNA纳米花比免疫磁珠具有更高比表面积,更丰富的结合位点,能够通过程序编辑承载多种适配体探针,实现多靶标高效率的EVs捕获;其次,DNA纳米花可以用DNA核酸酶进行降解除去,从而将捕获的EVs释放出来,进行后续实验;此外,由于磁珠不透光,因此对磁珠表面EVs进行光学检测的时候存在很大的干扰现象。而DNA纳米花具有非常好的透光性,可以对EVs进行免疫染色,直接在溶液中进行光谱定量分析。DNA纳米花提供了一种非常方便实用的EVs分离检测技术,可以满足不同目的的研究需求。
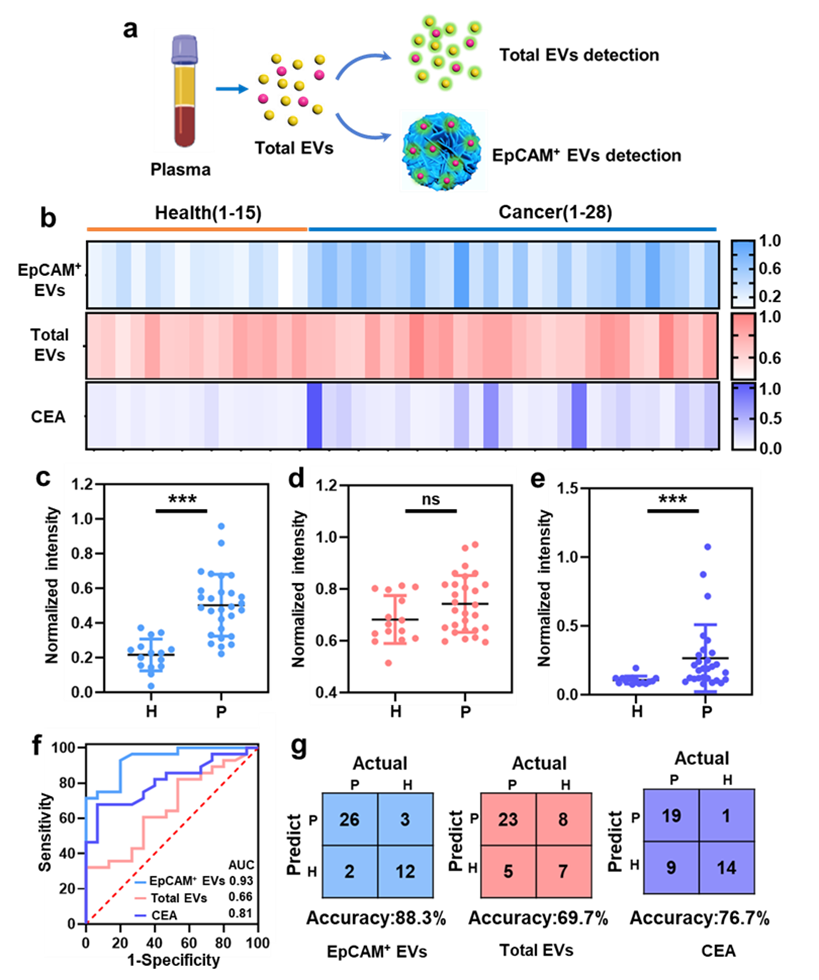
为了探索DNA纳米花在癌症诊断中的临床应用,该团队收集了15名健康志愿者(H1-15)和28名癌症患者(P1-18肺,P19-28结肠)的血浆样本,分别评估了总EVs和EpCAM+EVs的数量。如图2所示,健康志愿者与癌症患者的EVs总量无显著差异。虽然有证据表明癌细胞分泌EVs的能力增强,但癌细胞分泌的EVs在整个血浆EVs中所占的比例可能很低,因此很难对EVs总量做出显著改变。相反,肺癌和结直肠癌患者中EpCAM+ EVs的数量远高于健康样本,这与以往文献中血浆中EpCAM阳性EVs可作为有效生物标志物的观点一致。此外,该团队还比较了他们的方法与临床常见标志物(CEA)在癌症诊断中的准确性。结果表明基于DNA纳米花的方法优于CEA检测。
外泌体资讯网 ACS Appl Mater Interfaces|浙大姚波/王敏/北大医疗鲁中医院路阳:DNA纳米花用于高效分离检测肿瘤EVs





