近日,江南大学附属医院肿瘤研究所黄朝晖团队联合江南大学生物工程学院糖化学生物技术教育部重点实验室吴志猛团队在国际权威期刊Journal of Controlled Release发表了题为“An off-the-shelf small extracellular vesicle nanomedicine for tumor targeting therapy”的研究成果(2023 Nov 16:364:672-686);江南大学博士研究生龚亮和硕士研究生田璐为文章的共同第一作者,黄朝晖研究员和吴志猛教授为论文共同通讯作者。
依托江南大学市校共建平台,黄朝晖研究员与吴志猛教授共同领衔的科研团队近些年在利用纳米抗体和外泌体进行肿瘤治疗方面取得了一系列重要进展,不仅提出了多个基于纳米抗体的肿瘤免疫治疗新策略(Chem Sci. 2021,12:4623-4630.;Angew Chem Int Ed Engl. 2022,61:e202208773),还成功地利用纳米抗体修饰NK细胞,获得的纳米抗体工程化NK细胞用于肿瘤过继细胞免疫治疗,显示了良好的抗肿瘤效果(Small. 2021,17(45):e2103463;封面论文)。
此外,该联合团队还利用外泌体向肿瘤细胞靶向递送化疗药物、微小RNA等治疗分子,获得了良好的抗肿瘤治疗效果(Cancer Med, 2020, 9:5989–5998;Carbohydr Res, 2020,493:108032; Cells. 2022,11:3065.)。然而,团队在研究过程中发现外泌体药物的制备工艺较为繁琐,药物装载和肿瘤靶向配基修饰往往需要分步进行,期间还需经过多次纯化和分离步骤,严重限制了外泌体药物的临床应用。针对该技术瓶颈,项目组提出了一种“一步法”策略生产可以直接使用的外泌体药物。该研究在前期构建的稳定表达泛癌抑制因子miR-204-5p的HEK293T细胞基础上(Cancer Med, 2020,9:5989-5998),利用慢病毒技术将构建的CD47-纳米抗体7D12融合蛋白在上述稳定细胞中高效表达,建立了可高效稳定表达CD47-7D12融合蛋白和miR-204-5p的工程化稳定细胞株。一系列验证实验显示,该细胞分泌的工程化外泌体不仅包裹了高丰度的miR-204-5p,而且其表面修饰了纳米抗体7D12和CD47功能蛋白。该工程化的外泌体不仅表现出显著增强的抵抗巨噬细胞吞噬的能力,体内半衰期显著延长,还能与肿瘤细胞表面免疫检查点CD47竞争性结合巨噬细胞,促进巨噬细胞对肿瘤细胞的吞噬作用。EGFR是一个重要的泛癌驱动因子,在多种恶性实体瘤中表达上调。该工程化外泌体表面修饰的EGFR纳米抗体7D12,可高效靶向EGFR阳性肿瘤,进而递送泛癌抑制因子miR-204-5p进入肿瘤细胞,发挥抗癌作用。移植瘤小鼠治疗结果显示,该工程化外泌体具有良好的体内抗癌活性,并具有良好的安全性。
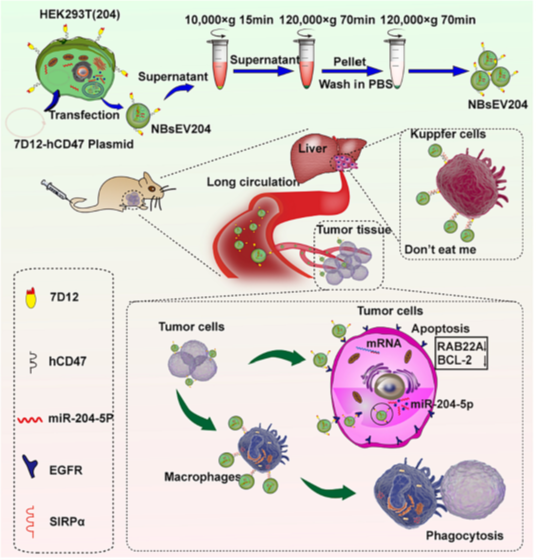
图.“现货”策略制备的抗肿瘤外泌体药物及其应用
总之,该研究设计和构建了一种工程化细胞株,其分泌的外泌体可直接用于抗肿瘤靶向治疗,无需繁琐的药物装载、靶向修饰和分离纯化等中间环节,大大提高了外泌体药物生产的效率,降低了成本。该策略有望促进外泌体纳米药物的临床转化。该研究得到了江苏省重点研发计划等多个基金的资助。
参考文献:
An off-the-shelf small extracellular vesicle nanomedicine for tumor targeting therapy, J Control Release. 2023 Nov 16:364:672-686. doi: 10.1016/j.jconrel.2023.11.013.
外泌体资讯网 J Control Release | 江南大学附属医院黄朝晖/生物工程学院吴志猛团队:工程化外泌体靶向治疗恶性肿瘤新策略





