Extracellular Vesicles (EVs) 是由细胞释放到细胞外空间的纳米级囊泡,在细胞间通讯中扮演关键角色,因此在多种生理和病理过程中具有重要意义。为了更好地理解EVs的功能和其在疾病中的角色,科学家们长期以来一直在努力开发分离和检测EVs的方法。然而,传统的EVs分离方法主要基于EVs的物理化学参数,缺乏时间分辨率的考量;由于刺激后新生EV和刺激前已存在的旧EV没有明确的理化性质差异,因此现有的分离分析技术难以对二者进行区分。这些方法学上的局限性导致很难实现EVs动态变化的准确监测,从而影响对其功能的深入解读。近日,一篇从时间维度上分离细胞外囊泡(EVs)的研究, 进入了公众视野。该项研究提供了一种新的视角,为细胞外囊泡分离分析和发现细胞外囊泡标志物提供了新方向。2023年10月,厦门大学宋彦龄团队于Nature Communications发表的研究:“Capturing Nascent Extracellular Vesicles by Metabolic Glycan Labeling-Assisted Microfluidics”(2023 Oct 17;14(1):6541) 结合了代谢聚糖标记与微流体技术,成功实现了从血浆中选择性地分离在外部刺激下新产生的EVs。该研究的通讯作者是厦门大学化学化工学院宋彦龄教授,主要研究领域为分子定向进化、微流控分析、生物力学分析等。
该研究提出了一种结合代谢聚糖标记和点击化学的微流控富集策略,简称“Melac-Chip”策略。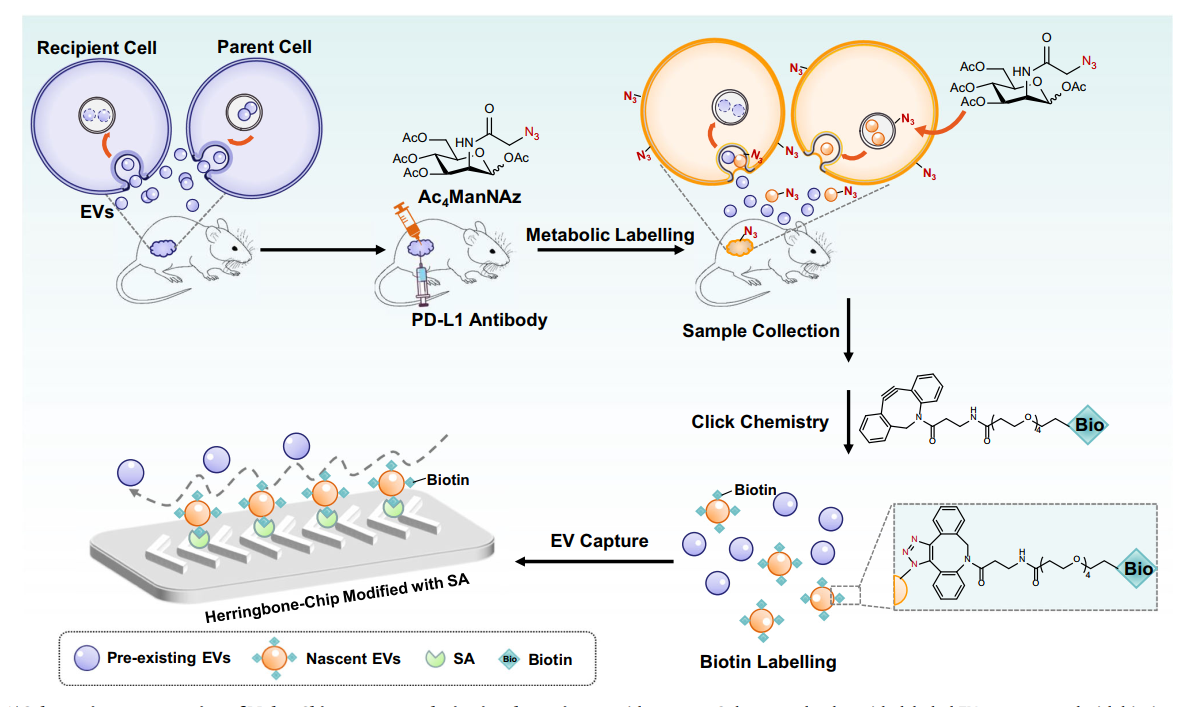
“Melac-Chip”策略示意图:在肿瘤老鼠接收免疫治疗(PD-L1抗体治疗)的同时注射Ac4ManNAz进行葡萄糖代谢标记;此后,小鼠体内新产生的EV会带有叠氮标记;通过与DBCO-PEG4-Biotin共价反应后,带有Biotin标记的新生EVs可以被链霉亲和素(SA)修饰的芯片选择性捕获。在实验中,研究者证明了非天然糖Ac4ManNAz可成功在EVs上标记叠氮官能团,并不显著影响EV的物理特征和蛋白组分,并且利用Melac-Chip策略可实现叠氮EV的选择性分离和检测。在4T1乳腺肿瘤小鼠模型中,研究者进一步证明了这种策略的有效性,并揭示了PD-L1抗体免疫治疗后,新生的PD-L1+ EVs与肿瘤体积的正关系性远优于无时间区分的PD-L1+ CD63+EVs与肿瘤体积的相关性,这一发现为癌症治疗疗效监控提供了全新的视角。Melac-Chip策略为EVs的研究提供了一个强大的工具,不仅可以实现时间维度上的免疫治疗响应的EV动态监测,而且还可以应用于广泛刺激下的EV动态研究,有望应用于微生物感染、环境变化等对EV分泌影响的探究。Capturing nascent extracellular vesicles by metabolic glycan labeling-assisted microfluidics. Nat Commun. 2023, 14(1):6541. Doi: 10.1038/s41467-023-42248-9.外泌体资讯网 Nat Commun | 厦门大学宋彦龄团队:从时间维度上分离分析细胞外囊泡






