细胞外囊泡(Extracellular vesicles,EVs)是由细胞释放的脂质双分子层分隔的膜结构,在细胞间通讯和疾病发展中发挥重要作用。EV在诊断和治疗领域的全球市场正在扩展中。近日,来自哥伦比亚大学程柯教授和MD Anderson癌症中心Raghu Kalluri教授合作发表综述,对目前EV产业及制造、临床前和临床研究进行了系统总结,对EV研究发展和严格的EV产品大规模生产提供了指南。相关内容以“Guidelines for clinical translation and commercialization of extracellular vesicles and exosomes based therapeutics”为题在线发表于9月30日的Elsevier旗下的细胞外囊泡学术期刊Extracellular Vesicle上。
细胞外囊泡(EVs)是一种具有脂质双分子层的颗粒,从细胞中被自然释放出来,不能自我复制。EV一般分为两大类:ectosomes和exosomes。Ectosomes是由质膜直接向外出芽而产生的囊泡,产生微囊泡、凋亡小体、迁移小体等大囊泡,直径在50nm ~ 1mm之间。相比之下,外泌体exosomes起源于内体,直径在40到160纳米之间。然而,最近的一项研究通过追踪外泌体生物标志物挑战了这种二元论,使膜起源和内体起源之间的界限更加模糊。在这些EV中,外泌体已被广泛研究,通常以经典的四次跨膜蛋白如CD9、CD63和CD81为特征。但是异质性外泌体群不能通过单一的生物标志物来定义,需要通过综合的方法来表征。
EV在疾病发展和潜在治疗中的作用正在被大家所熟知,同时伴随着EV产业领域呈指数级增长。全球外泌体诊断市场预计将从2021年的5710万美元增长到2026年的3.219亿美元,而外泌体治疗市场预计将从2021年的3310万美元增长到2026年的1.692亿美元。尽管我们在EV生物学及其应用领域取得了重大进展,但这些颗粒的容量尚未被充分利用于任何潜在的商业用途。EV的分析和制造需要标准化,以适应临床应用。然而,迄今为止,对临床应用的EV相关产品的分离方法和释放标准尚未达成共识。
在这篇指南中,作者综述了EV产业的现状,总结了EV制造的最新进展,并重点介绍了EV的临床前研究。EV的复杂性和异质性为临床级EV产品的开发提供了新的机遇,因此标准化的生产和强有力的质量控制必须满足所有食品和药物管理局(FDA)的要求和期望。
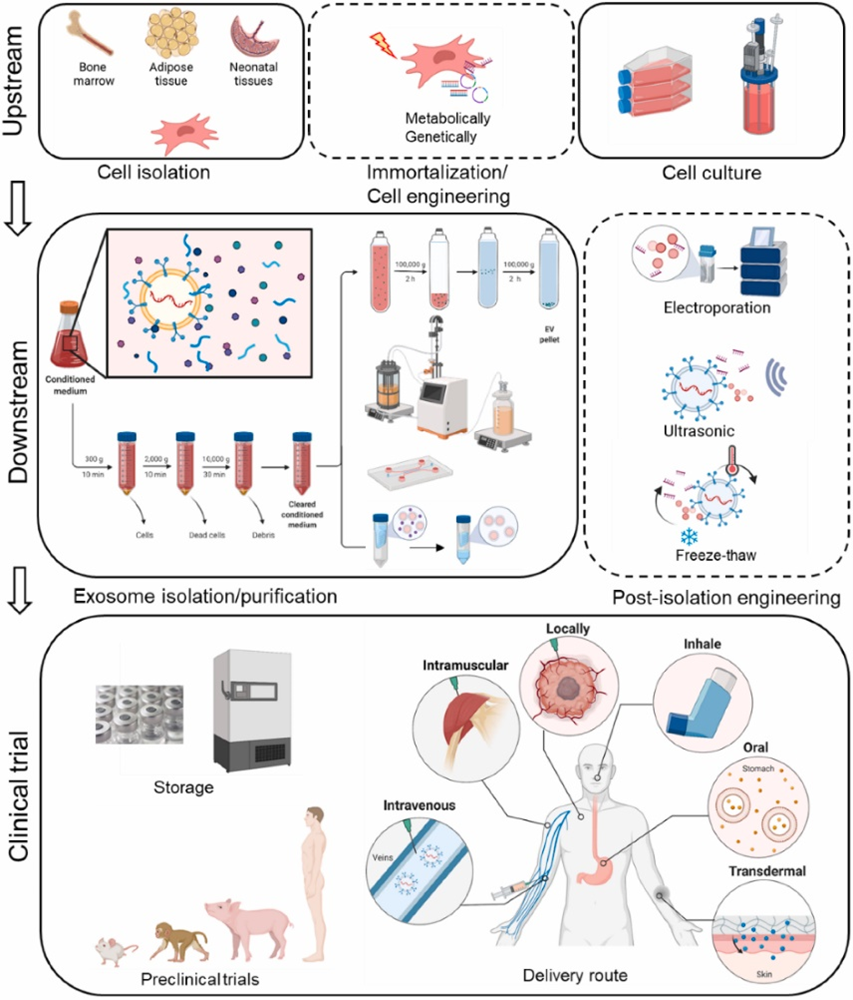
首先,作者对EV行业现状进行了描绘。EV除了可作为多种疾病的生物标志物和治疗药物外,还可以作为药物和其他疗法的载体。随着对可扩展的EV产品和标准细胞培养技术的发展需求的增加,EV分离和表征公司也在蓬勃发展。作者列举了目前的EV公司和临床试验(用于诊断和治疗),重点介绍他们的技术、产品和应用,讨论了大规模生产的瓶颈,概述了临床转化的困难。
然后,在EV制造方面,作者逐一介绍了EV的来源、EV的2D 和3D培养和大规模培养、EV的分离方法、EV产品过程和最终发布标准等内容。
在EV临床前研究和临床方案方面,作者做了很多考虑。临床前研究包括细胞研究和动物研究,目前更多的研究人员正在使用大型动物或灵长类动物来进一步测试EV产品的功效和安全性。如果治疗有希望,研究人员可以向FDA提交研究新药(IND)申请。一旦IND获得批准,该药物就可以进入I期临床试验。大多数EV疗法都处于I期试验,在少数受试者中进行加速剂量测试,以确定任何副作用。EV对人体的安全性越来越被人们所接受。需要更详细的临床方案来开展II期临床试验,以在更大的人群中测试EV的功效。
EV的剂量通常基于EV的蛋白质含量或颗粒浓度。以静脉注射MSC-EVs为例,根据之前的研究,需要1012 EV/kg 初始EV和2×1010EV /kg的给药剂量。作者推断,人体可能需要大约一万亿个EV来进行全身EV治疗。
药代动力学研究对于阐明外泌体的生物学功能和发展基于外泌体的治疗具有重要意义。外泌体可能通过非肠道给药,但也有可能通过非肠道或口服给药。外泌体也可以局部使用或纳入支架等装置。静脉注射的EVs主要进入肝脏并被巨噬细胞吞噬。然而,EV的分布在很大程度上取决于细胞来源。
FDA快速通道程序解决了广泛的严重疾病和未满足的医疗需求。制药公司可以提交其生物许可证申请(BLA)或新药申请(NDA)的完整部分供FDA审查,而不是等到每个部分都完成。用于治疗某些疾病的EV疗法有可能获得优先审查,并有资格通过快速通道程序获得FDA的加速批准。
到目前为止,FDA还没有批准EV产品用于治疗。FDA提供指导,告知申办者如何提供足够的化学、生产和控制信息,以确保产品安全、标识、质量、纯度和强度(包括效力)。此外,FDA和世界各地的其他监管机构对用于减轻、治疗、治愈或预防疾病的生物制剂有特定的要求。从细胞培养基中分离和纯化外泌体需要对质量、纯度、效力和可重复性进行严格控制。外泌体的后续修饰需要额外的控制。外泌体的规格可能包括它们的起源细胞及其内容物的规格。EV的发布标准需要更多的评估和标准化。随着我们对EV的理解和分离技术的发展,以EV为基础的产品时代即将到来。