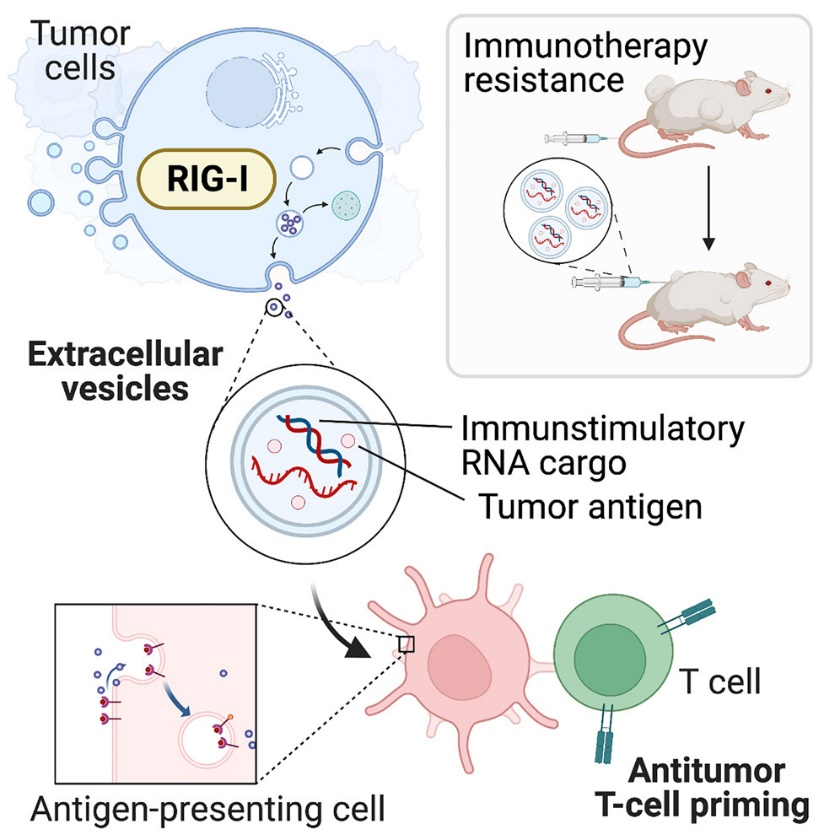
肿瘤来源的细胞外囊泡(EVs)与免疫逃避和肿瘤进展有关。来自德国慕尼黑工业大学医学院的研究人员发现,肿瘤细胞固有的胞质内RNA感应受体RIG-I和干扰素IFN-I信号可以用于产生免疫原性肿瘤EV,从而触发有效的抗肿瘤T细胞反应,并与基于免疫检查点阻断(ICB)的免疫治疗产生协同作用。相关内容以“Targeting nucleic acid sensors in tumor cells to reprogram biogenesis and RNA cargo of extracellular vesicles for T cell-mediated cancer immunotherapy” 为题于9月19日在线发表在Cell Press出版社旗下子刊、转化和临床生物医学类前沿期刊Cell Reports Medicine杂志上。
研究机制示意图。该研究结果显示:RIG-I活性调节肿瘤细胞源性EV的生物发生和功能;癌症固有的RIG-I信号控制EV RNA货物的组成;免疫刺激性EV在小鼠和人体内触发基于T细胞的抗肿瘤免疫;黑色素瘤中的EV和RIG-I基因特征与免疫治疗反应相关。
以免疫检查点阻断(immune checkpoint blockade,ICB)为根本的癌症免疫治疗已经显示出对实体和血液系统恶性肿瘤的巨大临床疗效,但ICB的反应异质性仍然是一个临床挑战。因此,更好地了解驱动ICB诱导的抗肿瘤反应和治疗耐药的机制是很重要的。参与I型干扰素(IFN-I)诱导的胞质核酸感应途径——特别是cGAS/STING和RIG-I/MAVS途径——在产生抗原特异性抗肿瘤免疫应答中至关重要。DNA传感器cGAS和下游效应物STING构成细胞质模式识别受体系统,该系统识别来自外源(微生物病原体、死细胞)和内源(例如线粒体损伤)的细胞质DNA衍生物,从而触发先天免疫基因转录和IFN-I的产生。抗CTLA-4和抗PD-1的ICB的成功治疗都依赖于肿瘤微环境(TME)中的cGAS/STING信号。胞质RNA受体RIG-I(由DDX58基因编码)检测来自外源和内源(如病毒、细菌、非编码RNA [ncRNAs])的双链5 ' -三磷酸RNA (3pRNA),通过适配器分子MAVS和转录因子IRF3/IRF7的下游信号传导可以诱导有效的IFN-I产生。在TME中靶向cGAS/STING和RIG-I的治疗方案已经证明,通过宿主免疫细胞产生IFN-I,并同时诱导恶性细胞的调控细胞死亡,具有强大的抗肿瘤作用。研究团队此前发现,抗CTLA-4的免疫治疗及其联合抗PD -1或放射治疗依赖于肿瘤细胞内在的RIG-I的激活,而不是STING信号。然而,肿瘤细胞内这些核酸受体途径激活后肿瘤与宿主之间的通讯机制仍不清楚。
细胞外囊泡(extracellular vesicles,EVs)作为细胞间信息传递的一种新模式,已成为研究的热点。EV是一组异质性的膜包裹囊泡,几乎可以从包括癌细胞在内的所有细胞中释放出来。根据EV生物发生的机制,可以区分出不同的类群:微泡(microvesicles)/胞外体(ectosomes)是由质膜直接向外出芽形成的,而外泌体(exosomes)起源于内体系统。EV携带大量的生物活性货物,包括蛋白质、脂质、代谢物和核酸,这些货物因其细胞来源的类型和功能状态而有很大差异。EV调节靶细胞内复杂的细胞内通路的内在特性引起了人们对其在癌症治疗控制中的潜在效用的广泛兴趣。在TME内释放的EV主要被认为是免疫抑制和对抗免疫治疗的,然而EV在癌症中的作用可能存在动态调控,并且与癌症类型、遗传和阶段有关。研究还发现,EV以一种依赖环境的方式引发了强有力的免疫反应。肿瘤来源的EV可以通过肿瘤相关抗原(TAAs)的转移和随后特异性T细胞的交叉启动诱导树突状细胞(DCs)的激活。然而,肿瘤细胞释放这种免疫刺激EV的条件、所涉及的信号通路、它们对基于T细胞的抗肿瘤免疫的影响以及因此与临床建立的免疫疗法的相互作用仍不清楚。
在这项研究里,研究人员系统地剖析了控制肿瘤EV的生物发生、货物和免疫调节功能的关键分子。研究人员发现肿瘤细胞内的RIG-I控制着EV的生物发生和免疫调节功能。癌症固有的RIG-I激活释放EV,介导树突状细胞成熟和T细胞抗肿瘤免疫,与免疫检查点阻断治疗存在协同作用。肿瘤细胞中完整的RIG-I、自分泌干扰素信号和GTPase Rab27a是免疫刺激EV生物发生所必需的。活跃的内在RIG-I信号控制肿瘤EV RNA货物的组成,包括小的非编码刺激RNA。黑色素瘤样本中EV通路基因和RIG-I的高转录活性与患者生存期的延长和对免疫治疗的有益反应有关。人类黑色素瘤在RIG-I刺激后产生的EV可诱导有效的抗原特异性T细胞反应。因此,研究人员定义了一种分子途径,可以在肿瘤中靶向,以有利地改变EV免疫调节功能。该研究提出了肿瘤EV的“重编程”作为T细胞介导的癌症免疫治疗的个性化策略。
参考文献:Targeting nucleic acid sensors in tumor cells to reprogram biogenesis and RNA cargo of extracellular vesicles for T cell-mediated cancer immunotherapy. Cell Rep Med. 2023 Sep 19;4(9):101171.