帕金森病是全球第二大神经退行性疾病,α-突触核蛋白被认为是帕金森病发病机制中最重要的致病因素之一。在临床上,将帕金森病与几种具有相似症状的神经系统疾病区分开来是十分具有困难的,尤其是多系统萎缩。多系统萎缩是一种罕见的神经退行性疾病,其临床特点包括进行性的自主神经功能障碍、小脑性共济失调。在临床上,有时很难将以帕金森症为突出表现的多系统萎缩(MSA-P型)与帕金森病区分开来,尤其是在疾病早期。尽管大部分关于帕金森病和多系统萎缩的研究主要集中在神经元和少突胶质细胞,但星形胶质细胞也参与了多种神经退行性疾病的发展过程。例如,α-突触核蛋白在帕金森病患者的星形胶质细胞中出现积聚,但反应性星形胶质细胞的增生有限;在多系统萎缩中,反应性星形胶质细胞的数量增加,但星形胶质细胞内并没有明显的α-突触核蛋白聚集。星形胶质细胞中病理性α-突触核蛋白的积聚可能会破坏正常的细胞稳态。然而,关于星形胶质细胞病理性α-突触核蛋白的来源和清除机制仍存在争议。研究表明细胞外囊泡(EVs)在细胞处理不需要的物质方面起着重要作用。除了维持多个细胞系统的稳态外,EVs还作为携带各种疾病生物标志物的载体而被广泛研究。2023年8月25日,浙江大学医学院附属第一医院章京教授团队在国际知名期刊《Translational Neurodegeneration》在线发表题为“α-Synuclein-carrying astrocytic extracellular vesicles in Parkinson pathogenesis and diagnosis”的研究论文(2023 Aug 25;12(1):40)。这项研究揭示了病理性α-突触核蛋白沉积可能导致星形胶质细胞的溶酶体功能障碍,从而刺激星形胶质细胞释放更多的EVs。这些外周血液中星形胶质细胞来源的携带α-突触核蛋白的EVs,可能成为帕金森病的临床诊断或鉴别诊断的有效生物标志物。
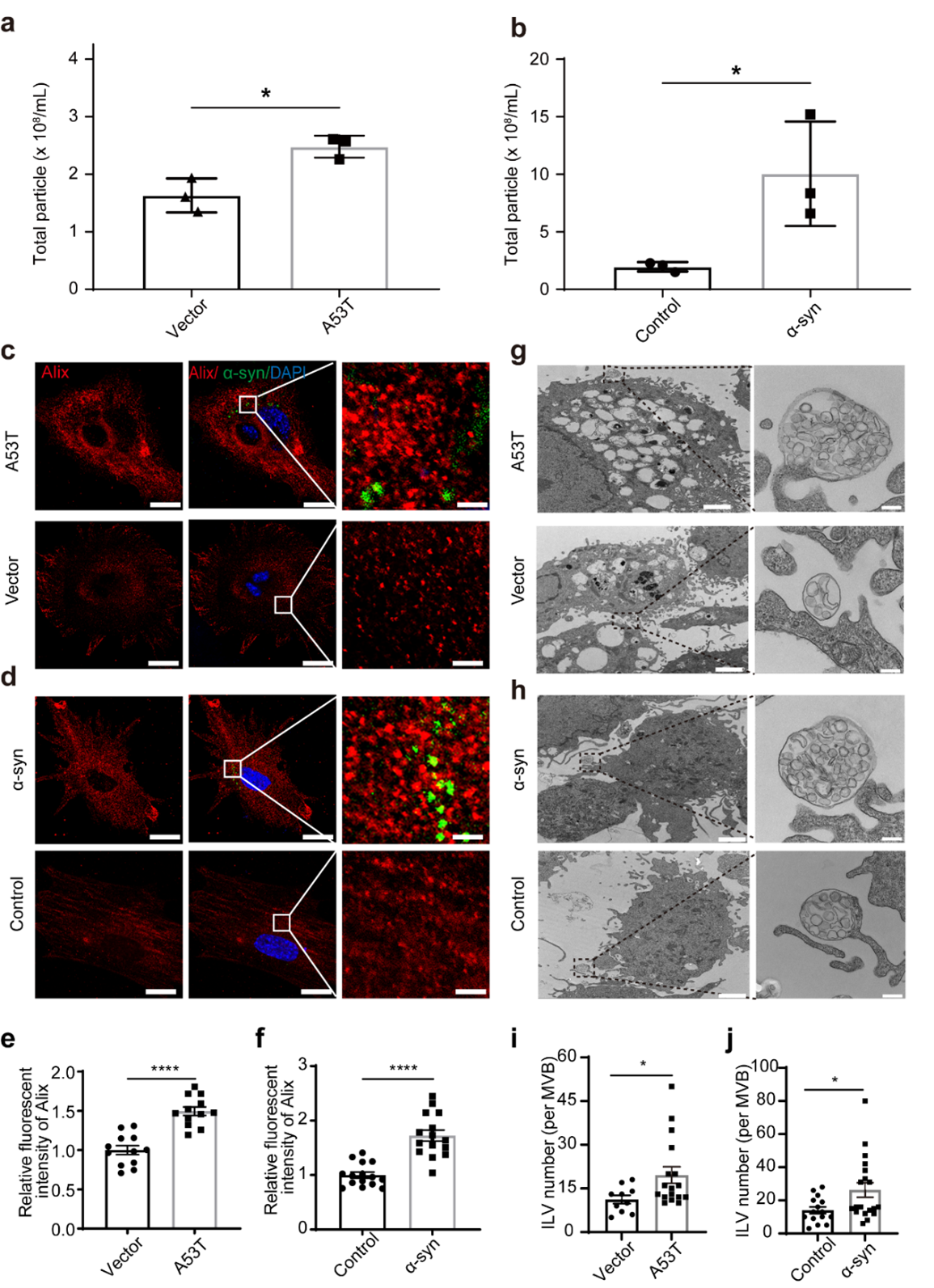
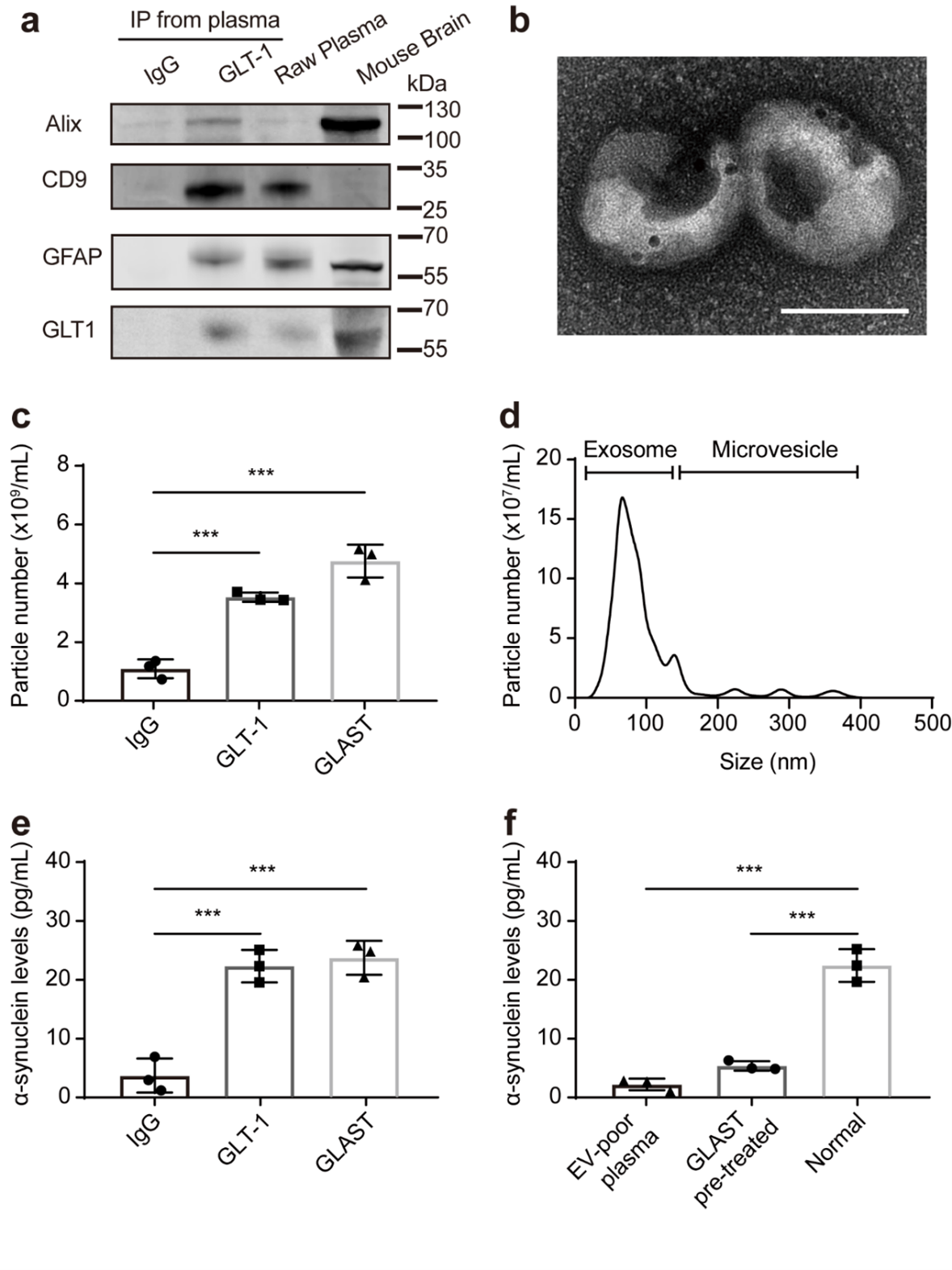
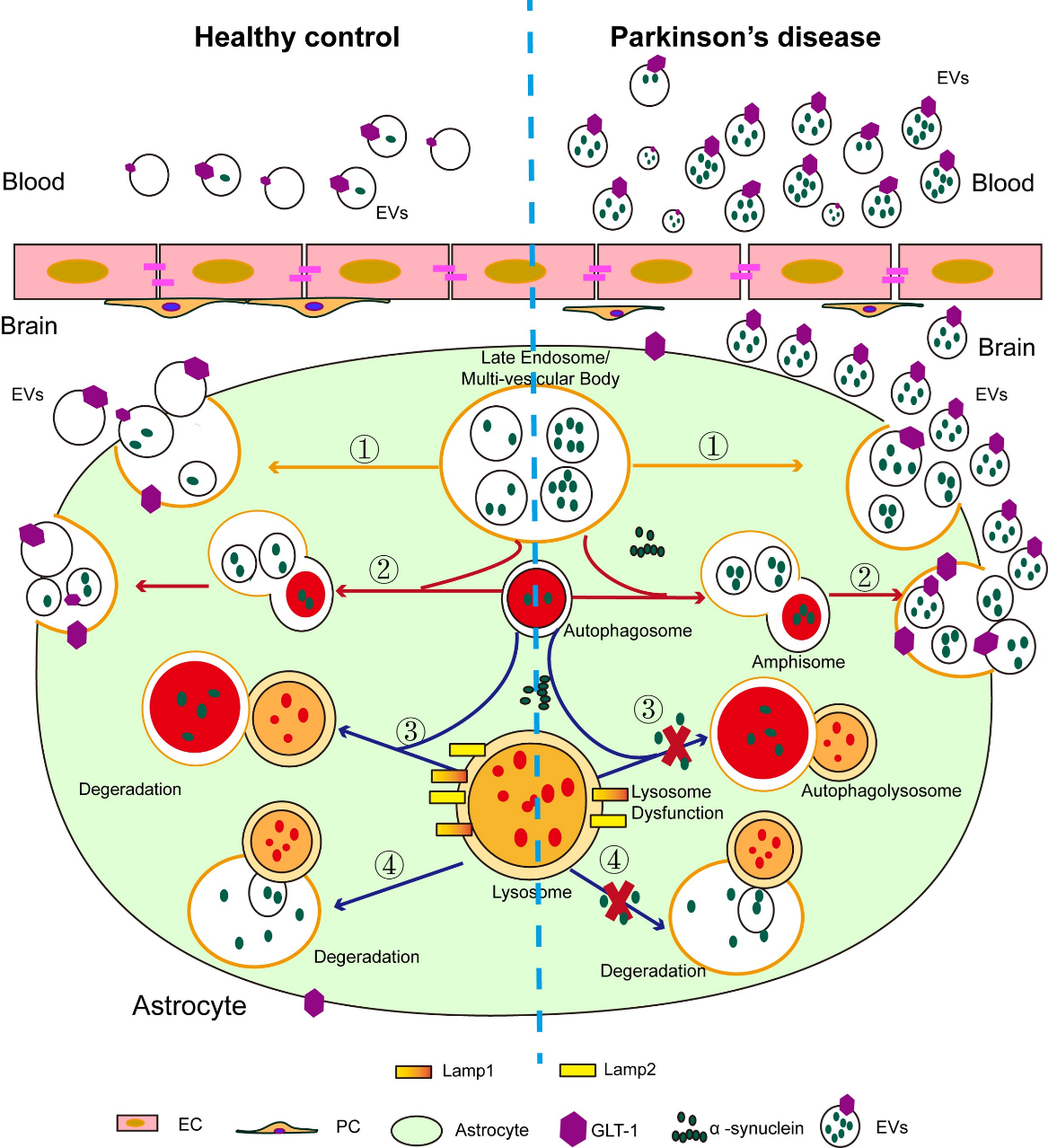
星形胶质细胞在大脑功能中扮演着不可或缺的角色,它们积极与神经元、小胶质细胞和其他星形胶质细胞相互作用,参与血脑屏障完整性的维持、神经递质的循环利用和能量稳态调节。研究表明病理性的α-突触核蛋白在帕金森病的星形胶质细胞中积聚明显增多,并且星形胶质细胞中α-突触核蛋白的内吞可能参与帕金森病的进展和相关神经炎症。因而该研究团队提出关键科学问题:病理性的α-突触核蛋白聚集的星形胶质细胞来源的EVs能否作为帕金森病的早期诊断、鉴别诊断的有效生物标志物?研究团队首先对病理性α-突触核蛋白对星形胶质细胞来源EVs的释放进行评估。结果表明病理性α-突触核蛋白聚集可以增加星形胶质细胞的EVs分泌、多囊泡体(MVBs)数量增加(图1)。图1:病理性α-突触核蛋白聚集促进星形胶质细胞的EVs分泌通常,MVBs与细胞质膜融合以释放外泌体,或通过溶酶体途径降解。鉴于病理性α-突触核蛋白聚集促进星形胶质细胞EVs分泌增加和MVB数量的增加,研究团队提出假设:星形胶质细胞中的病理性α-突触核蛋白积聚是否会诱导溶酶体功能障碍,从而导致星形胶质细胞EVs分泌的增加。研究团队基于关键溶酶体水解酶(Cathepsin B,CTSB;Cathepsin D,CTSD和Cathepsin L,CTSL)的活性、CTSL蛋白水平(包括前体、中间体和成熟形式)、LysoTracker Red染色以及溶酶体关联膜蛋白Lamp1和Lamp2的水平评估了星形胶质细胞的溶酶体功能。结果表明星形胶质细胞中α-突触核蛋白聚集可以显著降低溶酶体功能,而不会诱导明显的星形胶质细胞凋亡。研究表明胞质LC3与自噬体功能相关,为了进一步探索病理性α-突触核蛋白在星形胶质细胞溶酶体功能障碍中的作用,研究团队进一步评估了LC3-阳性的自噬体的数量以及LC3I/II和SQSTM1/p62蛋白水平。这些结果进一步表明,病理性α-突触核蛋白引起的星形胶质细胞EVs分泌的增加部分归因于溶酶体功能障碍。为了进一步探索星形胶质细胞的EVs(AEVs)能否作为帕金森病的早期诊断标志物,研究团队对血浆中的AEVs进行了捕获和表征。为了捕获血浆中AEVs,基于团队的前期研究,研究团队选择了GLT-1(一种在中枢神经系统中几乎特异在星形胶质细胞中广泛分布的兴奋性氨基酸转运蛋白,负责在脑组织中摄取细胞外谷氨酸)对AEVs进行捕获。结果显示,从血浆中捕获的GLT-1阳性的AEVs在电镜下显示出典型的直径约100 nm的EVs形态,同时含有Alix和CD9(典型的外泌体标志物)以及GFAP和GLT-1(典型的星形胶质细胞标志物)。这些发现表明,AEVs存在于人体外周血中,并可以通过抗GLT-1抗体进行分离。考虑到α-突触核蛋白在AEVs分泌中的促进作用,另一个重要的问题是这些血浆中的AEVs是否携带了与帕金森病相关的α-突触核蛋白。基于此,团队进一步使用了高灵敏的电化学免疫发光技术(MSD)法测量AEVs中的α-突触核蛋白水平。结果显示,通过GLT-1富集的AEVs中携带了大量的α-突触核蛋白。(图2)为了进一步测试血浆中AEVs作为帕金森病早期诊断及鉴别诊断的生物标志物的潜力,研究团队对之前开发的Apogee检测方法进行了优化,以测量血浆中GLT-1阳性和α-突触核蛋白阳性的EVs。结果显示,在血浆中可以检测到GLT-1阳性、SYN211阳性、MJFR14阳性的EVs,并验证了该流式检测方法的灵敏性、特异性、稳定性和稀释线性。通过优化的检测方法,研究团队对健康对照组和帕金森病患者或多系统萎缩症患者的临床血浆样本进行了双盲检测。结果显示帕金森病患者组中的GLT-1阳性、SYN211阳性和MJFR14阳性EVs水平均显著高于健康对照组,而多系统萎缩症组与健康对照组之间没有显著差异。帕金森病组中的GLT-1阳性和SYN211阳性的EVs水平明显高于多系统萎缩症患者组。研究团队进一步进行了受试者工作特性(ROC)分析,评估AEVs将帕金森病患者与健康对照或多系统萎缩症患者区分开的诊断性能。结果表明:结合GLT-1阳性/SYN211阳性的EVs和GLT-1阳性/MJFR14阳性的EVs区分帕金森病患者与健康对照的AUC为0.915(95% CI = 0.877-0.954,敏感性 = 81.6%,特异性 = 89.6%),区分帕金森病患者与多系统萎缩症患者的AUC为0.877(95% CI = 0.807-0.946,敏感性 = 78.7%,特异性 = 89.6%)。图2:血浆中星形胶质细胞来源细胞外囊泡的鉴定和α-突触核蛋白浓度检测总结来说,这项研究聚焦于带有α-突触核蛋白的星形胶质细胞来源的EVs在帕金森病发生发展中的功能,并分析其作为生物标志物进行诊断的潜力。研究结果显示,星形胶质细胞中α-突触核蛋白沉积导致AEV分泌数量显著增加,而这种增加机制部分可以归因于溶酶体功能障碍。在帕金森病患者中,携带α-突触核蛋白的AEVs数量明显高于健康对照组和多系统萎缩症患者。结合AEVs、总α-突触核蛋白和聚集α-突触核蛋白的综合模型在区分帕金森病与健康对照组以及多系统萎缩症方面表现出有效的诊断能力,其AUC分别为0.915和0.877(图3)。因此,外周血中含有α-突触核蛋白的AEVs可能成为临床诊断或鉴别诊断帕金森病的有效生物标志物。图3:星形胶质细胞中α-突触核蛋白沉积导致AEV分泌数量显著增加,而这种增加机制部分可以归因于溶酶体功能障碍。外周血中含有α-突触核蛋白的AEVs可能成为临床诊断或鉴别诊断帕金森病的有效生物标志物浙江大学医学院附属第一医院章京教授、杨迎特聘副研究员、首都医学大学北京天坛医院冯涛教授是本文的共同通讯作者,博士后王盼及博士生兰国钰是共同第一作者。该研究获得了法国波尔多大学医院Wassilios G.教授的有力支持。该研究主要受国家自然科学基金(81571226,82020108012,82001200和81671187)、浙江创新和创业领域团队(2020R01001)、浙江大学创新转化基金、浙江省自然科学基金(LZ23H090002)等资助。团队秉承着开放包容的理念,常年面向海内外诚聘全职博士后、特聘研究员、特聘副研究员和科研助理,诚邀有识之士的“你”来加盟。此外,团队每年有多个博士生、硕士生名额,如有兴趣,请联系杨老师rebecca_yang@zju.edu.cn。α-Synuclein-carrying astrocytic extracellular vesicles in Parkinson pathogenesis and diagnosis, Transl Neurodegener.2023 Aug 25;12(1):40. doi: 10.1186/s40035-023-00372-y.原文链接:https://translationalneurodegeneration.biomedcentral.com/articles/10.1186/s40035-023-00372-y外泌体资讯网 Transl Neurodegener|浙江大学章京教授团队发现星形胶质细胞来源细胞外囊泡在帕金森病疾病诊断中的重要价值