侵袭转移和化疗耐药是导致三阴性乳腺癌(triple-negative breast cancer,TNBC)患者术后复发和高死亡率的主要原因。lnc RNA DARS-AS1异常高表达与TNBC细胞的侵袭转移和化疗耐药密切相关。然而,有关DARS-AS1表达增加促进TNBC侵袭转移和化疗耐药的作用机制目前尚不清楚。
近日,西北工业大学生命学院尹大川教授、张辰艳副教授团队在国际著名期刊International Journal of Biological Macromolecules上发表了题为“CL4-modified exosomes deliver lncRNA DARS-AS1 siRNA to suppress triple-negative breast cancer progression and attenuate doxorubicin resistance by inhibiting autophagy”的研究论文(doi: 10.1016/j.ijbiomac.2023.126147)。研究报道了lncRNA DARS-AS1异常高表达可促进三阴性乳腺癌(triple-negative breast cancer,TNBC)的侵袭转移,并诱导肿瘤细胞的保护性自噬进而介导阿霉素(doxorubicin,DOX)化疗耐药,通过构建靶向TNBC的EXOs-CL4工程化纳米递药系统进行DARS-AS1 siRNA和DOX联合递药,可通过阻断TGF-β/Smad3信号通路协同抑制TNBC侵袭转移和化疗耐药。
作者通过构建靶向TNBC细胞膜表面EGFR的寡核苷酸适配体CL4工程化的内源性EXOs(EXOs-CL4)靶向纳米递药系统,进行DARS-AS1 siRNA和DOX联合递药,观察其对TNBC侵袭转移和DOX化疗耐药的影响。结果表明,采用siDARS-AS1/DOX@EXOs-CL4载药靶向纳米递药系统治疗能够有效实现TNBC的体内外靶向性,并抑制TNBC的体内成瘤、转移和DOX化疗耐药。进一步研究表明,DAR-AS1表达上调通过激活TGF-β/Smad3信号通路介导肿瘤细胞的保护性自噬,进而促进TNBC细胞的侵袭转移和DOX化疗耐药,并使用该信号通路特异性抑制剂LY2157299在细胞和动物水平验证了此现象。因此,这项研究成果将为临床耐DOX的TNBC治疗提供新靶点和一种高效、安全的靶向纳米递药系统。
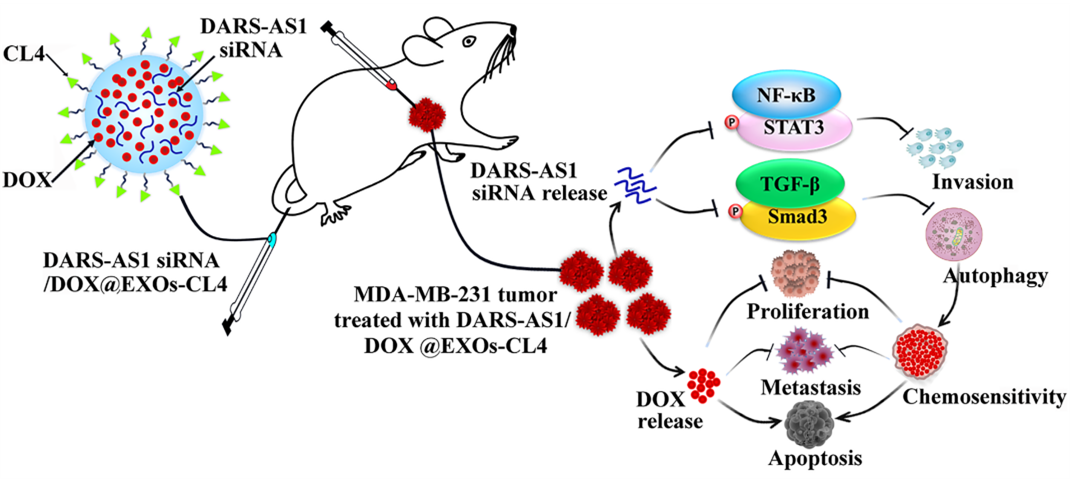
图1. siDARS-AS1/DOX@EXOs-CL4载药靶向纳米递药系统的协同抗肿瘤作用示意图
该项目研究得到了国家自然科学基金、陕西省重点研发计划、陕西省创新团队和西北工业大学博士学位论文创新基金支持。西北工业大学生命学院为第一单位,博士研究生刘新利为论文的第一作者,尹大川教授和张辰艳副教授为通讯作者。
参考文献:
CL4-modified exosomes deliver lncRNA DARS-AS1 siRNA to suppress triple-negative breast cancer progression and attenuate doxorubicin resistance by inhibiting autophagy. Int J Biol Macromol. 2023 Aug 04; 250: 126147. doi: 10.1016/j.ijbiomac.2023.126147. PMID: 37544559.
外泌体资讯网 Int J Biol Macromol | 西北工业大学生命学院尹大川/张辰艳团队构建了EXOs-CL4工程化靶向纳米递药系统用于抑制三阴性乳腺癌的侵袭转移和化疗耐药





