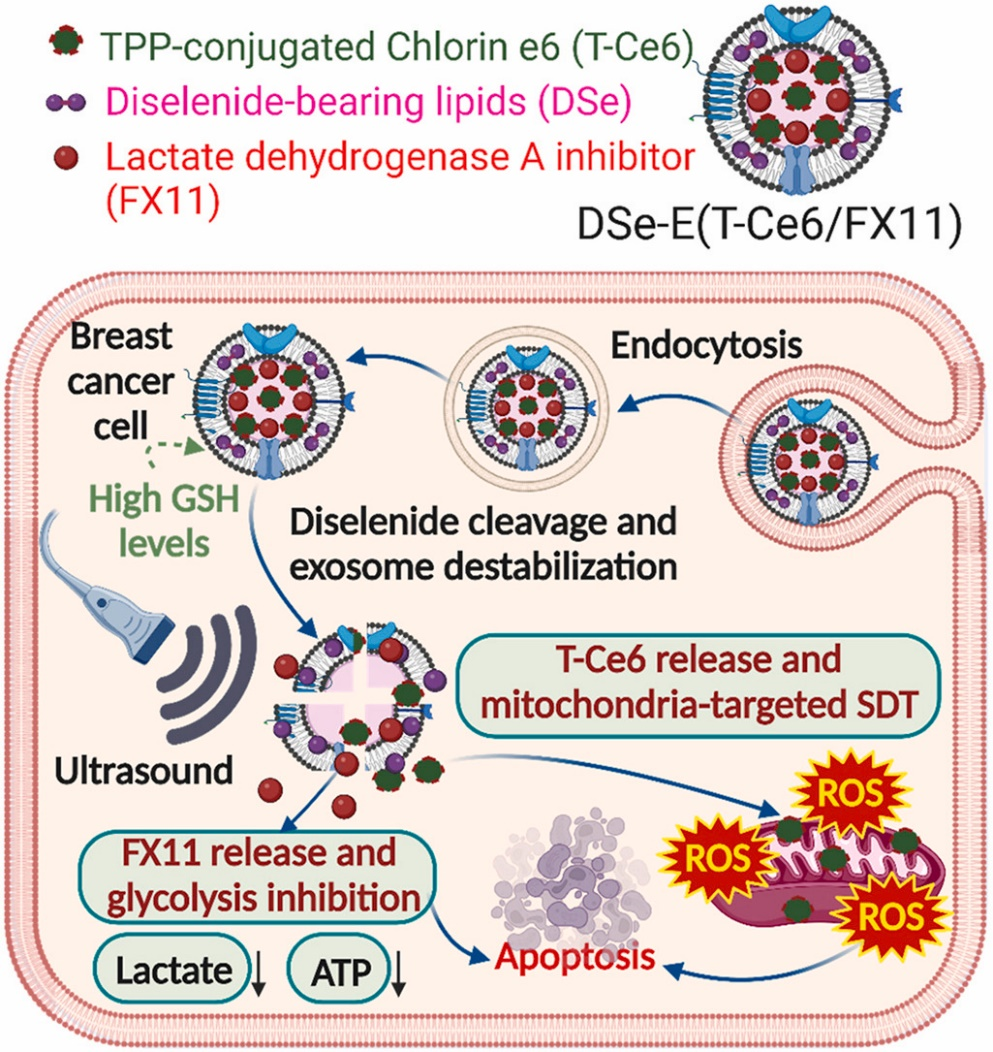
纳米载体辅助声动力治疗(SDT)克服了声敏剂的局限性,在深部肿瘤的有效和靶向治疗方面显示出巨大的潜力。然而,使用纳米载体的体内SDT仍然受到其固有毒性和非特异性货物释放的限制。来自韩国仁川国立大学的研究人员开发了一种工程化的生物可还原外泌体,用于安全且肿瘤特异性地递送线粒体靶向声敏剂T-Ce6和糖酵解抑制剂FX11。携带氧化还原酶可切割的二硒键连接体脂质被嵌入外泌体中,以触发肿瘤微环境中过度表达的谷胱甘肽的药物释放。通过显著的糖酵解抑制和线粒体靶向的SDT治疗,实现了有效的肿瘤治疗效果。相关内容以“Bioreducible exosomes encapsulating glycolysis inhibitors potentiate mitochondria-targeted sonodynamic cancer therapy via cancer-targeted drug release and cellular energy depletion” 为题于7月11日在线发表在国际知名材料学领域期刊Biomaterials杂志上。
图:生物可降解的T-Ce6/FX11促进T-Ce6和FX11在富含GSH的肿瘤细胞微环境中的胞质释放。超声激活T-Ce6在线粒体内产生ROS, FX11抑制细胞内ATP的产生,通过线粒体靶向声动力肿瘤治疗和细胞能量消耗相结合,触发细胞凋亡。
声动力治疗(Sonodynamic therapy,SDT)是一种利用超声(US)进行非侵入性和靶向性癌症治疗的治疗技术,近年来因其能够穿透深层组织并实现时空特异性而受到广泛关注。SDT的性能在很大程度上依赖于超声作用下声敏剂产生活性氧(ROS)的能力。然而,大多数声敏剂都有一定的局限性,包括缺乏细胞特异性、生物相容性差、药代动力学特性差,这极大地限制了它们在体内SDT效果。基于纳米材料的声敏剂递送已被证明是一种改善声敏剂细胞内运输、细胞特异性、生物相容性和体内药代动力学特性的有效方法。尽管纳米颗粒递送系统具有优势,但其固有的毒性和网状内皮系统(reticuloendothelial system,RES)的不良清除阻碍了其临床转化。因此,开发具有高生物安全性和生物利用度的声敏剂纳米载体对安全高效的体内SDT至关重要。
外泌体是一种纳米级的细胞衍生囊泡,成为安全有效的SDT的内源性纳米载体。外泌体的内源性特性表现出特殊的生物相容性,能够绕过生物屏障,延长血液循环时间。重要的是,纳米级外泌体通过增强的渗透性和滞留效应(enhanced permeability and retention,EPR)在肿瘤中积累。尽管外泌体在肿瘤靶向药物递送方面具有巨大潜力,但天然外泌体也存在局限性,例如难以按需进行药物释放。因此,工程化外泌体促进有效载荷的释放以响应肿瘤特异性指标,同时避免在脱靶部位的过早药物释放是至关重要的。
肿瘤微环境具有独特的生理信号,包括酸性pH、缺氧、多类酶的过表达和谷胱甘肽(GSH)水平升高,有利于肿瘤细胞的增殖和转移。值得注意的是,肿瘤组织中GSH水平明显高于正常组织。利用肿瘤富含GSH的还原环境,各种具有二硒键(或二硫键)的GSH反应性纳米载体已被广泛研究用于肿瘤靶向药物递送。因此,具有二硒键的工程化外泌体可能通过有效切割二硒键来响应肿瘤细胞中过量产生的GSH,从而实现肿瘤靶向药物递送。
癌细胞通常严重依赖糖酵解产生三磷酸腺苷(ATP),即使在氧气充足的情况下(被称为Warburg效应)。癌细胞对糖酵解的依赖性增强,不仅提供了细胞能量,还产生了对大分子生物合成至关重要的代谢中间体,促进细胞增殖、侵袭和耐药。最近的研究表明,阻断癌细胞的糖酵解过程可以协同增强其他癌症治疗,如化疗和光动力治疗。因此有理由推测,糖酵解抑制可能会增强SDT治疗肿瘤的疗效。然而,到目前为止,很少有研究报道了声动力联合糖酵解抑制用于癌症治疗。
在这项研究中,研究人员开发了GSH反应性的含二硒键外泌体,用于安全且肿瘤特异性地递送超声增敏剂和糖酵解抑制剂。携带二硒键的外泌体具有生物可还原性,因为二硒键通过与肿瘤细胞中过量产生的谷胱甘肽的还原反应被切割。二氢卟吩e6(Chlorin e6,Ce6)作为一种声敏剂与线粒体靶向的三苯膦(triphenylphosphonium, TPP)偶联,并包被在含二硒键的外泌体中,实现线粒体靶向的SDT。由于线粒体是调节细胞死亡和存活的关键细胞器,靶向线粒体已被认为是治疗癌症的有效策略。
除了靶向线粒体的声敏剂外,FX11,一种有效的乳酸脱氢酶A (LDHA)抑制剂,被装载到外泌体中以抑制癌细胞的糖酵解。因此,研究人员认为,装载FX11的外泌体可以通过靶向能量代谢,显著提高SDT的治疗性能,这是一种选择性和有效治疗癌症的新方法。此外,由于外泌体固有的长时间血液循环能力,生物可降解外泌体将大大提高线粒体靶向超声增敏剂的生物利用度,这对于有效和靶向体内SDT至关重要。
研究人员对这种生物可还原性外泌体的理化性质和药物释放谱进行了表征,并在体外和体内验证了SDT联合能量消耗疗法的抗肿瘤效果。结果显示,生物可还原外泌体在肿瘤细胞的还原环境中促进其有效载荷的细胞质释放。当超声照射时,工程化外泌体显著增强药物释放和声动力效应。线粒体靶向T-Ce6的积累有效地破坏了US照射下细胞的线粒体,加速了凋亡细胞的死亡。FX11显著抑制细胞能量代谢,增强线粒体靶向SDT的抗肿瘤作用。生物可还原外泌体通过线粒体靶向SDT和能量代谢靶向治疗的结合,有效抑制小鼠肿瘤生长,无明显的全身毒性。这项研究为使用双刺激反应外泌体包封声敏剂用于安全和靶向SDT治疗提供了新的见解。
参考文献:Bioreducible exosomes encapsulating glycolysis inhibitors potentiate mitochondria-targeted sonodynamic cancer therapy via cancer-targeted drug release and cellular energy depletion. Biomaterials. 2023 Jul 11;301:122242.