细胞外囊泡(EVs)和非囊泡(NV)细胞外纳米颗粒(NVEPs)在生理和病理条件下都发挥着关键作用。然而,EVs和NVEPs领域的一个主要挑战是它们的异质性以及用于分离和纯化不同种群的方法。此外,该领域主要关注与EVs相关的研究,而与细胞外非囊泡性NVEPs的研究,包括最近发现的exomeres和supermeres,是有限的。然而,越来越清楚的是,不同类别的EVs可能包含特定的载荷,并且同样重要的是,NVEPs(例如exomeres和supermeres)包含许多生物分子,包括蛋白质、RNA和DNA,这些生物分子以前被归因于外泌体。EVs的大小范围从小型EVs(sEVs; <200 nm),包括从内体区生成的外泌体,到大型EVs(lEVs; >200 nm),包括从质膜脱落的微小囊泡和大型oncosomes。NVEPs包括一系列粒子大小,包括脂蛋白、exomeres和supermeres。流体相原子力显微镜(AFM)揭示了supermeres与sEVs和exomeres具有不同的形态特征。为了理解EVs和NVEPs在基本细胞生物学中的作用,以及实现它们的完整临床潜力,需要强大而可靠的方法来分离这些颗粒的不同种群。已经广泛描述了不同的EV分离方法,包括差速超速离心、尺寸排除色谱、超滤、免疫捕获和微流控技术。超速离心是从细胞、组织和血浆中分离EVs和NVEPs的金标准,高分辨率密度梯度纯化已被证明可以进一步分离NV材料与纯化的囊泡。基于离心的分离方案具有相对较高的产量优势,超速离心机广泛应用于基础和临床研究实验室。该protocol提供了如何从人类细胞系和人类血浆中可重复获得高度纯化的lEVs、sEVs、exomeres和supermeres的详细描述。此外,还描述了如何通过添加去白蛋白步骤来改善从血浆中纯化exomeres和supermeres的方法。该领域的主要挑战涉及EVs和NVEPs的异质性以及用于分离和纯化不同种群的各种方法。越来越清楚的是,传统上分离的“外泌体”或“EV”样品包含EVs和NV组分的异质混合物。EV领域的进展受到缺乏将各种分泌小囊泡与NV组分分离的方法的限制。此外,对EVs和脂蛋白的研究较多,而对最近发现的exomeres和supermeres的研究非常有限。从血浆和其他体液中分离EVs和NVEPs具有挑战性。大多数EV研究集中在从细胞培养基中分离EVs上,而从血浆和其他体液中分离EV和脂蛋白的报告更为有限,但是有许多使用不同技术组合的方案可用。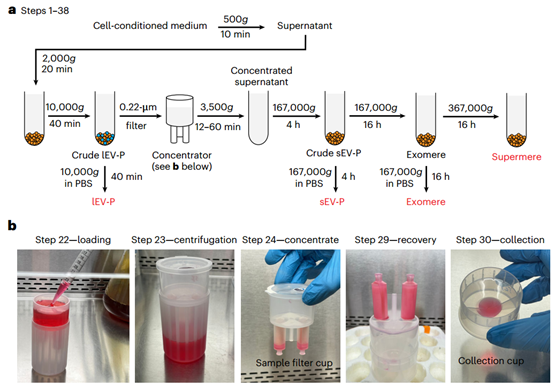
a、大EV颗粒(lEV-Ps)、小EV颗粒(sEV-Ps)、exomeres和supermeres的分离示意图。无血清培养基经过离心(500g和2,000g)去除死细胞、细胞碎片和凋亡体。在10,000g离心40分钟后,通过超速离心离心上清液获得lEV-P。剩余的上清液首先被浓缩,然后在167,000g超速离心4小时,以获得sEV-P(通过在167,000g超速离心4小时后用PBS洗涤一次)。从前一步骤的上清液在167,000g离心16小时以分离exomeres(通过在167,000g超速离心16小时后用PBS洗涤一次)。从前一步骤的上清液在367,000g离心16小时以分离supermeres。b、来自a中浓缩器过程中最重要步骤的代表性照片。
a、通过高分辨率碘克沙醇密度梯度分离(12-36%,重量/体积)的方法生成lEVs或sEVs和NV组分的示意图。lEV-Ps或sEV-Ps的粗提液在冰冷的PBS中重悬,并与冰冷的碘克沙醇(OptiPrep)/PBS混合,以获得最终36%(重量/体积)碘克沙醇溶液。将悬液加入离心管底部,并在其上小心地分层PBS中浓度逐渐降低的碘克沙醇溶液(30%、24%、18%和12%),形成完整的梯度。底部加载的12-36%(重量/体积)梯度在120,000g超速离心15小时。从梯度顶部收集了1毫升的12个单独组分。前六个组分在一个管中混合,后五个组分在第二个管中混合。管子里装满PBS并混合。在120,000g超速离心4小时后,两个颗粒分别代表纯化的EVs和NVs。b、来自a中高分辨率梯度分离过程中最重要步骤的代表性照片。- 3. 从人血浆中分离lEV、sEV、exomeres和supermeres
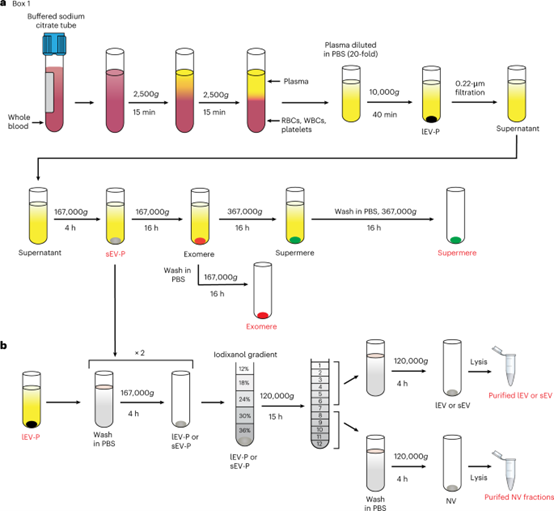
a、从血浆中分离不同组分的示意图。通过在室温下两次以2,500g离心15分钟离心血液生成血浆。所得到的血浆样品立即在冰冷的PBS-HEPES(PBS-H)中稀释约1:10-20,并在10,000g离心40分钟以沉淀lEV-Ps。上清液通过0.22微米孔径聚醚砜(PES)过滤器过滤,然后将所得上清液分别在167,000g超速离心4小时和16小时,然后在367,000g离心16小时,以分离sEV-Ps、exomeres和supermeres。b、通过高分辨率碘二乙醇密度梯度分离(12-36%,重量/体积)的方法生成纯化血浆lEVs、sEVs和NV分数的示意图。lEV-Ps或sEV-Ps的粗颗粒按照图2所述进行处理。- 4. 高分辨率密度梯度离心将sEV与NV成分分离的效果
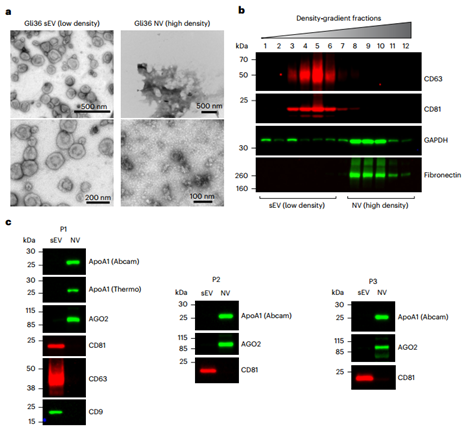
a、从高分辨率密度梯度中获得的Gli36细胞衍生的总sEV(低密度)和NV(高密度)组分的负染透射电镜。纯化的sEVs显示了EVs的预期杯状形态,而NV分数显示了很少的明显结构。b、来自DKO-1细胞的粗sEV-Ps的密度梯度分离。在高分辨率碘克沙醇梯度(12-36%,重量/体积)中浮选样品后,将每个组分的等体积加载到SDS-PAGE凝胶上,并用指示抗体免疫印迹膜。c、通过高分辨率密度梯度分离粗人类血浆sEV-Ps以获得纯化的sEV和NV组分。三个健康人类个体(P1-P3)血浆样品在分离后进行免疫印迹。ApoA1(HDL颗粒标记物)和AGO2在NV组分中富集,而CD81、CD63和CD9(sEV标记物)在sEV分数中富集。Zhang Q, Jeppesen DK, Higginbotham JN, Franklin JL, Coffey RJ. Comprehensive isolation of extracellular vesicles and nanoparticles. Nat Protoc. 2023 May;18(5):1462-1487. doi: 10.1038/s41596-023-00811-0. Epub 2023 Mar 13. PMID: 36914899.外泌体资讯网 Nature Protocols:细胞外囊泡和纳米颗粒的全面分离方案