小胶质细胞作为视网膜中常驻免疫细胞,其极化在介导视网膜缺血再灌注(I/R)损伤及修复过程中发挥重要作用,同时也是神经节细胞(RGCs)凋亡的主要病理机制之一。衰老可扰乱小胶质细胞的平衡,导致I/R后视网膜修复能力降低。来自年轻骨髓的干细胞抗原1阳性(BM Sca-1+)干细胞移植到视网膜I/R损伤后老年小鼠体内能够归巢并分化为视网膜小胶质细胞,具有更高的修复能力。BM Sca-1+外泌体作为一种安全的无细胞治疗方法,能够代替干细胞提供抗炎和微环境保护,为衰老视网膜I/R损伤治疗提供潜在新策略。
近日,哈尔滨医科大学附属第二医院眼科邵正波教授、原慧萍教授团队在利用年轻BM Sca-1+干细胞外泌体治疗视网膜I/R损伤方面取得新进展,在国际知名期刊Journal of Nanobiotechnology上发表了题为“Young Sca-1+ bone marrow stem cell-derived exosomes preserve visual function via the miR-150-5p/MEKK3/JNK/c-Jun pathway to reduce M1 microglial polarization”的文章(2023 Jun 15;21(1):194)。该文通讯作者是哈尔滨医科大学附属第二医院眼科邵正波教授、原慧萍教授,第一作者是汪源博士、覃莞芸硕士和王琦博士。该研究首次成功制备BM Sca-1+干细胞外泌体,并证实了其能通过其内部携带的miR-150-5p抑制MEKK3/JNK/c-Jun通路,减少小胶质细胞M1型极化,促进老年小鼠视网膜I/R损伤后视功能的修复及视网膜形态和功能的维持。
首先该研究通过免疫磁珠分选法从年轻小鼠骨髓中分选出BM Sca-1+和BM Sca-1-外泌体并对其进行鉴定。结果证实BM Sca-1+和BM Sca-1-外泌体具有外泌体的基本特征并且表达外泌体表面特异性蛋白(图1)。
随后,该研究使用老年小鼠构建了视网膜缺血再灌注(I/R)损伤模型,使用BM Sca-1+和BM Sca-1-外泌体玻腔注射入小鼠眼内,评估其对视功能的改善功效。结果证实BM Sca-1+外泌体能够明显改善视网膜I/R后的视功能,小鼠在明室中停留时间缩短,并且对不同频率的光栅均有更好的转头反应(图2)。
 图2 BM Sca-1+外泌体改善视网膜缺血再灌注(I/R)损伤后的视觉行为
图2 BM Sca-1+外泌体改善视网膜缺血再灌注(I/R)损伤后的视觉行为
除了能修复视功能,该研究还发现BM Sca-1+外泌体能对视网膜I/R损伤后视网膜形态的改变和RGCs的凋亡起到缓解作用。结果证实BM Sca-1+外泌体能提高视网膜I/R损伤后变薄的视网膜各层的厚度,抑制RGCs细胞的凋亡(图3)。
 图3 BM Sca-1+外泌体保护视网膜形态并减少I/R诱导的视网膜神经节细胞凋亡
图3 BM Sca-1+外泌体保护视网膜形态并减少I/R诱导的视网膜神经节细胞凋亡
该研究进一步发现,BM Sca-1+外泌体保护视网膜形态并减少I/R诱导的视网膜RGCs凋亡的同时抑制了视网膜小胶质细胞向M1型极化。结果显示,视网膜I/R损伤后代表促炎型M1小胶质细胞的CD16/32+细胞的比例增加,伴随着促炎细胞因子IL-6和TNF-α水平升高,而Sca-1+外泌体处理后视网膜M1小胶质细胞减少,且炎症因子分泌减少(图4)。
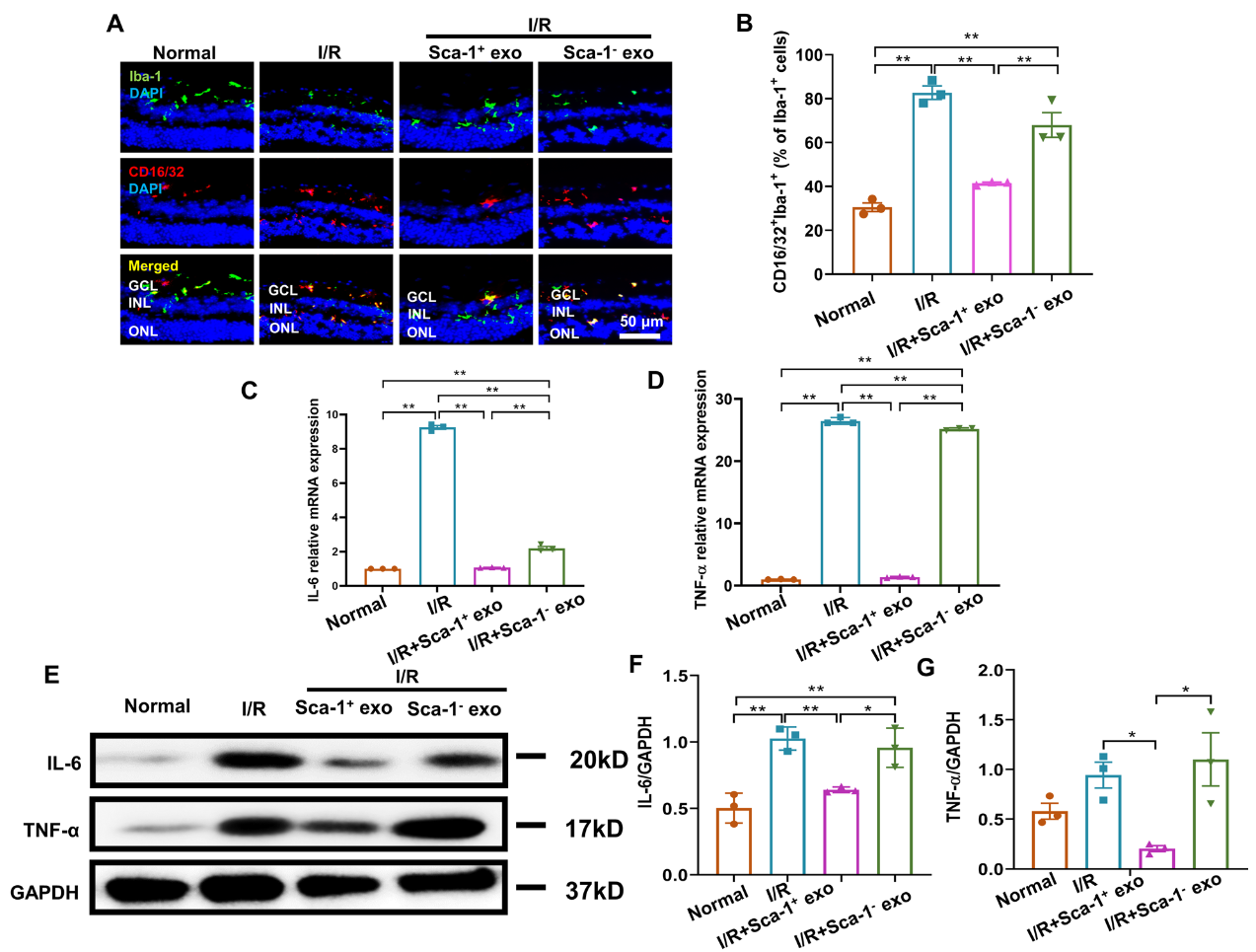 图4 Sca-1+外泌体减少视网膜I/R损伤后小胶质细胞向M1型极化
图4 Sca-1+外泌体减少视网膜I/R损伤后小胶质细胞向M1型极化
为了阐明BM Sca-1+外泌体修复作用背后的潜在分子机制,该研究对视网膜组织进行了高通量测序结合生物信息学分析,结果发现,BM Sca-1+外泌体和BM Sca-1-外泌体中存在数百个差异表达的miRNA,在这些miRNA中,差异最大的神经变性相关miRNA: miR-150-5p受到关注,其中与神经炎症通路相关的丝裂原活化蛋白激酶激酶激酶3(MAP3K3)基因即MEKK3在150个独立的数据库中被确定为miR-150-5p的共同靶基因(图5)。
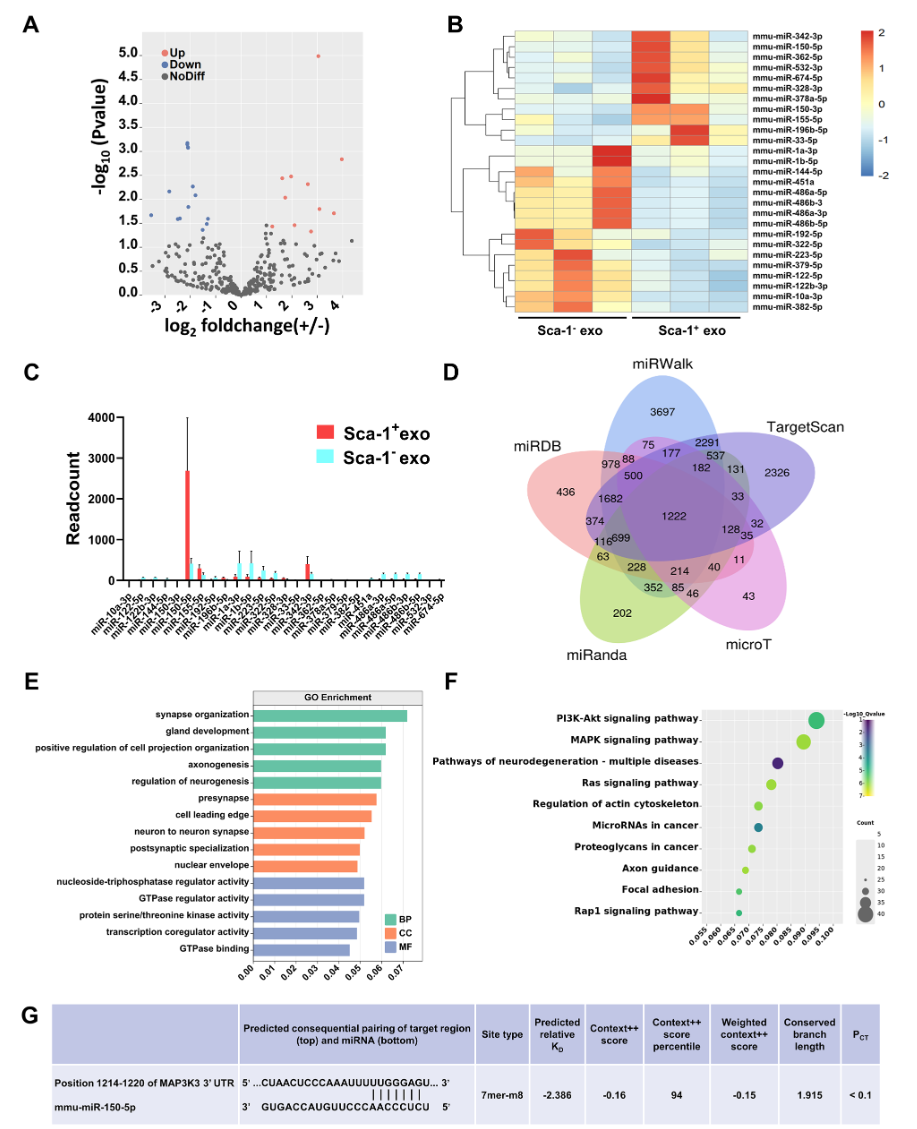 图5 miR-150-5p在Sca-1+外泌体中富集,并能靶向丝裂原活化蛋白激酶激酶激酶3(MAP3K3)即MEKK3
图5 miR-150-5p在Sca-1+外泌体中富集,并能靶向丝裂原活化蛋白激酶激酶激酶3(MAP3K3)即MEKK3
接下来该研究在体外探究BM Sca-1+外泌体中miR-150-5p调控小胶质细胞极化的机制。结果显示,LPS处理后的BV2小胶质细胞中miR-150-5p表达下降,但能通过外泌体给药后恢复丰度,这表明外泌体能将miRNA递送至小胶质细胞。同时BM Sca-1+外泌体给药后miR-150-5p靶基因丝裂原活化蛋白激酶激酶激酶3(MAP3K3)即MEKK3显着下调,进而抑制了JNK/c-Jun信号通路,最终导致下游炎症因子IL-6和TNF-α的表达减少(图6)。
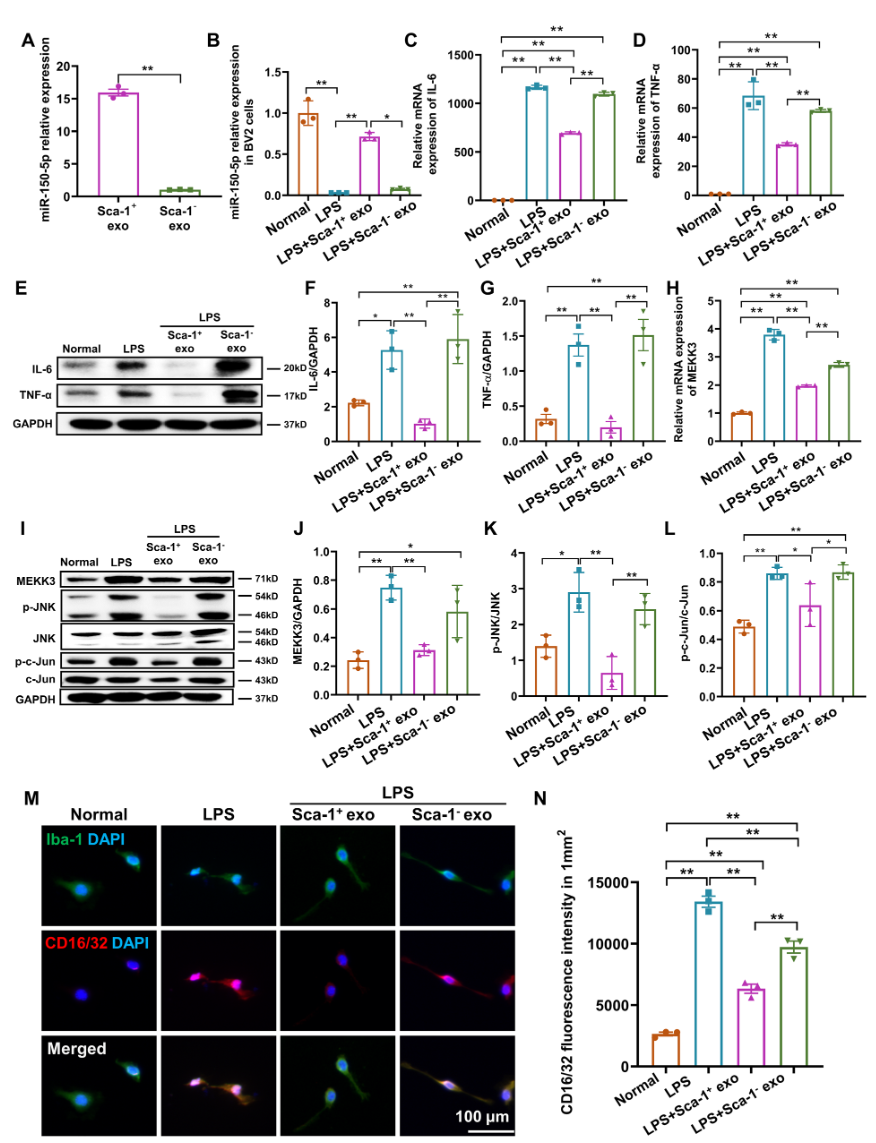 图6在脂多糖(LPS)诱导的BV2小胶质细胞中Sca-1+外泌体中富集的miR-150-5p下调MEKK3/JNK/c-Jun信号通路减少M1型小胶质细胞极化
图6在脂多糖(LPS)诱导的BV2小胶质细胞中Sca-1+外泌体中富集的miR-150-5p下调MEKK3/JNK/c-Jun信号通路减少M1型小胶质细胞极化
BM Sca-1+外泌体通过miR-150-5p对MEKK3/JNK/ c-Jun轴的抑制在体内中也得到了验证。老年小鼠视网膜I/R损伤后视网膜中miR-150-5p表达下降,玻腔注射的BM Sca-1+外泌体将miR-150-5p递送至视网膜,通过抑制MEKK3/JNK/c-Jun通路,减少了视网膜中小胶质细胞向M1型的极化,最后抑制了下游炎症因子IL-6和TNF-α的表达(图7)。然而, miR-150-5p可能不是Sca-1+外泌体神经保护作用背后的唯一因素, 11个在Sca-1+外泌体中显着上调,另外10种miRNA也可能有助于神经保护作用,该研究团队将在未来继续探究这些其他外泌体miRNA可能发挥的潜在神经保护作用。
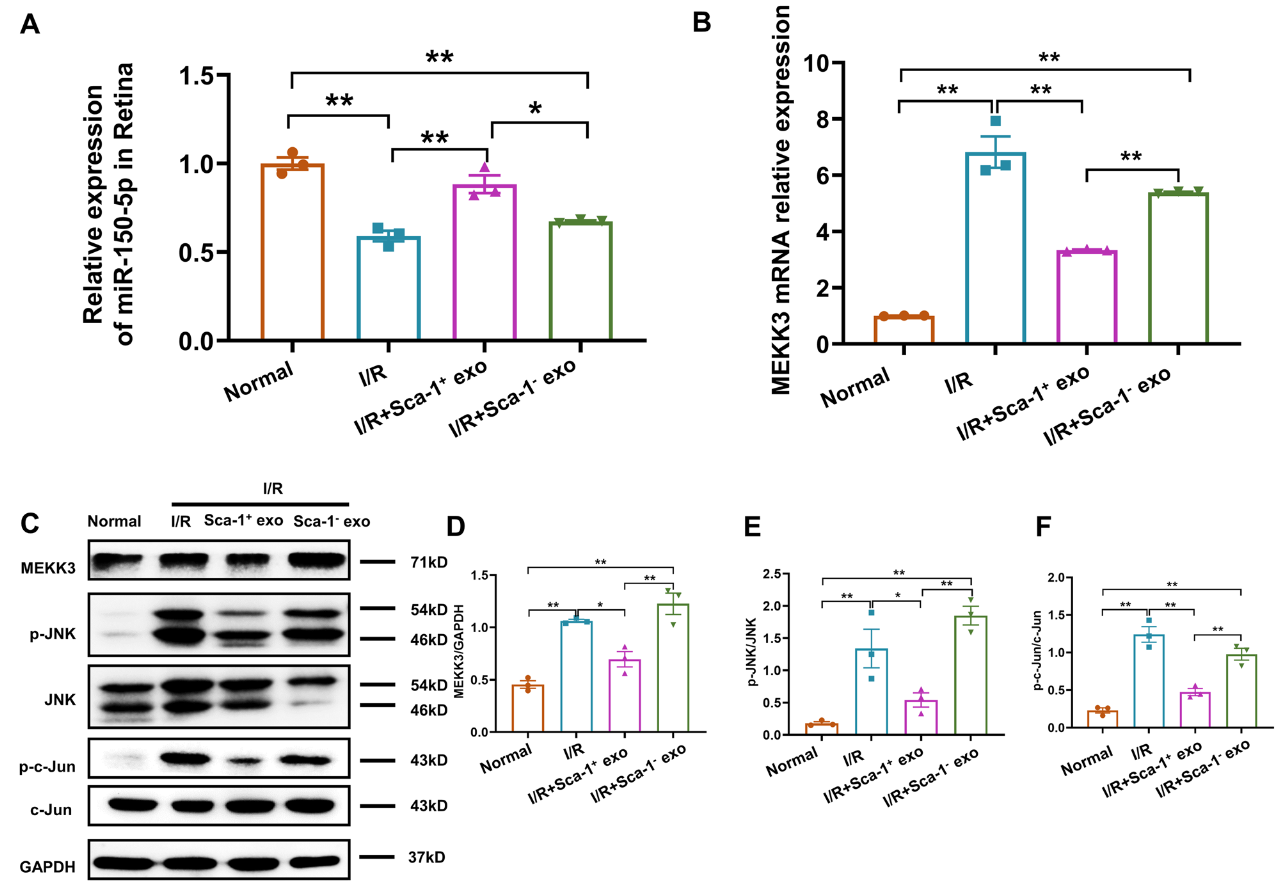 图7 Sca-1+外泌体递送miR-150-5p至体内视网膜下调I/R损伤后MEKK3/JNK/c-Jun信号
图7 Sca-1+外泌体递送miR-150-5p至体内视网膜下调I/R损伤后MEKK3/JNK/c-Jun信号
综上所述,该研究发现年轻的BM Sca-1+干细胞产生的外泌体能够抵消视网膜I/R损伤的影响,与Sca-1-外泌体相比,它们高度富集miR-150-5p,其作用于视网膜小胶质细胞以抑制MEKK3/JNK/c-Jun通路,减少M1小胶质细胞极化,使促炎细胞因子IL-6和TNF-α的表达降低,最终导致神经节细胞凋亡减少,维持视网膜形态并修复视觉功能。因此,Sca-1+外泌体可以作为视网膜I/R损伤的无细胞治疗的潜在方法。
参考文献:
Young Sca-1+ bone marrow stem cell-derived exosomes preserve visual function via the miR-150-5p/MEKK3/JNK/c-Jun pathway to reduce M1 microglial polarization, J Nanobiotechnology. 2023 Jun 15;21(1):194. doi: 10.1186/s12951-023-01944-w.





