最近的研究表明,细胞外囊泡(EV)表面分子常伴随有聚糖或者糖基化修饰。来自斯洛伐克国家科学院化学研究所的研究人员发表了研究型综述,讨论了糖基化在EV的形成、装载和释放中的作用,描述基于聚糖识别的方法和基于聚糖的分析用于EV的捕获和高灵敏度检测。此外,研究人员还提供了EV聚糖和聚糖加工酶作为潜在生物标志物、治疗靶点或再生医学应用工具的详细信息。相关内容以“Glycosylation in extracellular vesicles: Isolation, characterization, composition, analysis and clinical applications.”为题于6月10日在线发表在生物工程领域的国际学术期刊Biotechnology Advances杂志上。
本综述的内容提纲
- 聚糖在细胞外囊泡的形成、装载和释放中起着重要作用。
- 细胞外囊泡的聚糖部分形成一个生物分子电晕,厚度为5- 70nm。
- 甘聚糖法在无水条件下可检测到每微升1个细胞外囊泡。
- 细胞外囊泡中的聚糖主要使用集成多达45种凝集素的凝集素微阵列进行分析。
- 细胞外囊泡中的聚糖作为生物标志物具有广阔的应用前景。
细胞外囊泡(EVs)是由不同细胞分泌到细胞外空间的脂质双分子层结合囊泡。EV在细胞间通讯、基因表达调节、繁殖、细胞发育和增殖、伤口愈合、废物管理、代谢调节和重编程、信号传导、免疫反应、细胞凋亡和癌症发生和进展中发挥重要作用。EVs主要有两个亚群,包括外泌颗粒(ectosomes,50-10,000 nm)在质膜上通过膜出芽产生、外泌体(exosomes, 30-150 nm)在细胞内通过内体膜向内出芽产生。除了这两个主要的EV亚群,其他类型的EV也被描述过,包括迁移体(500-3,000 nm)、分泌性自噬体和自噬内涵体、外噬体(1,000-10,000 nm)和凋亡小体(50-5,000 nm)等。传统的EV分离方法包括超速离心、粒径分离层析、沉淀、萃取、超滤、免疫亲和捕获、微流体和基于电荷的分离技术。利用针对EV表面受体(如固定在磁珠(MB)上的CD9)的抗体对EV进行生物亲和性捕获的应用越来越广泛。直接比较表明,共价固定抗体在MB上的效果优于包被生物素修饰抗体的链酶亲和素结合的MB。研究人员建议,EV分离可以采用“鸡尾酒”的分离策略,包括多种分离方法一起,以实现高纯度和分离收率。本综述中也对基于MB的EV分离策略和基于亲和力的方法、其他纳米颗粒(NPs)用于分离EV的方法,包括基于聚糖的方法进行了叙述。EV被分离后保持其结构完整性至关重要。研究人员认为,不建议使用磷酸盐缓冲液(PBS)等传统缓冲液来储存EV,即使是稀释后的EV也不行,因为EV分散在PBS中不稳定。相反,作者建议将EV分散在添加海藻糖和人血清白蛋白的PBS中,进行EV处理并在-80°C下长期储存。由于EV是一种多种形式的粒子,因此需要使用一系列仪器技术来研究它们,包括光子学和生物光子学(拉曼光谱、傅里叶变换红外光谱、表面等离子体共振、流式细胞术、荧光成像)和其他技术(电子显微镜、原子力显微镜、纳米颗粒跟踪分析、核磁共振、动态光散射、质谱、微流体等)。这些技术不仅需要研究EV的组成、大小和数量,而且需要识别特定的标记。可以使用荧光染料对EV进行可视化,但EV的标记需要优化,因为一些常用的荧光染料只能标记一小部分EV,而且这些染料形成的聚集体与EV无关。此外,膜结合表面蛋白(含糖蛋白)也可以成功地用于EV分离和检测目的。比如,前列腺特异性膜抗原是一种众所周知的前列腺癌生物标志物,在尿中存在的前列腺源性外泌体中富集。其他癌症生物标志物,如人表皮生长因子受体2 (HER2或CD340或erbB-2),也可用于治疗目的,但并非所有细胞都表达该受体。除了蛋白质和脂质外,EV表面还存在多种类型的糖缀合物,包括O -聚糖、N -聚糖、糖脂神经节苷脂等类型的聚糖,可用于EV的分离。基于存在于EV表面的聚糖原理,利用基于凝集素的亲和层析实现海绵状聚合物分离细胞系生产的完整EV(124-134 nm)。研究表明,即使来自相同细胞类型和相同大小的EV,其表面表达的聚糖也具有异质性。因此有可能根据表面聚糖特征对EV进行分类。在本综述中,研究人员详细介绍了聚糖在典型尺寸为100-200nm的EV的形成、装载和释放过程中的重要作用。聚糖作为EV膜的组成部分,产生了厚度为5-70 nm的生物分子电晕,可以有效地用于EV的分离,特别是利用磁性颗粒。综述里提供了EV聚糖可用于液体活检、治疗应用和再生医学的证据,但可以预期的是,特别是对EV上存在的生物分子电晕的理解,可能会导致未来几年聚糖在许多临床应用中的重要性的研究呈指数级增长。基于EV聚糖的诊断的鲁棒性需要在数百个样本中进行验证,因此当AUC值大于0.8时,这种临床验证是可靠的。虽然各种类型的纳米颗粒,特别是磁性纳米颗粒被用于分离和表征EV,但可以预见的是,纳米颗粒将用于高灵敏度和强大的聚糖分析,并用于直接可视化膜上和EV生物分子电晕内的聚糖。在今后,EV聚糖将证明其作为一些疾病(包括各种类型的癌症)的临床生物标志物的潜力。到目前为止,只有通过代谢聚糖标记,才能对含有唾液酸残基的聚糖在EV上直接进行原位可视化。未来的一个巨大进步将是有工具来原位可视化其他类型的碳水化合物(例如焦糖),这些碳水化合物存在于经常与许多疾病相关的聚糖中。目前的一项重大进展是,有可能确定感兴趣的蛋白质(如PD-L1)是否含有含有唾液酸残基的聚糖。到目前为止,有两种方法描述了如何根据需要调整EV的糖基化。第一种是基于透明质酸对EV的修饰,结合代谢聚糖标记和修饰的EV靶向选定组织内细胞的能力。另一种方法是将糖基化结构域引入EV上存在的受体,随后使用聚糖加工酶(糖基转移酶或糖苷酶)对糖基化结构域进行糖基化。
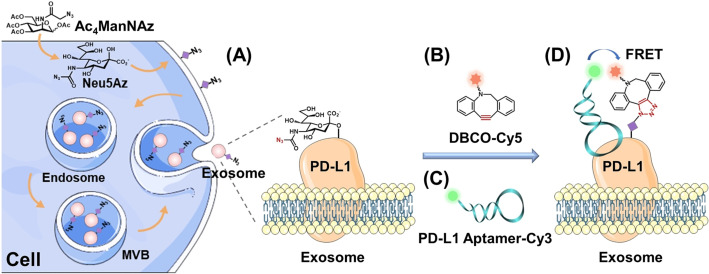
图:多种方法用于识别EV表面PD-L1的聚糖修饰。参考文献:Glycosylation in extracellular vesicles: Isolation, characterization, composition, analysis and clinical applications. Biotechnol Adv. 2023 Jun 10:108196.