胰腺癌治疗方案极其有限,预后较差,迫切需要在早期诊断和监测方面取得突破。磁共振成像(MRI)和计算机断层扫描(CT)等几种成像技术在胰腺癌早期诊断中检出率较低。同时,常用的单一肿瘤蛋白生物标志物检测在早期胰腺癌诊断中灵敏度和特异性不足,容易导致误诊或漏诊。液体活检是一种非常具有应用前景的非侵入性诊断方法。其中,肿瘤外泌体携带多种信号分子(蛋白质、脂质或核酸),与胰腺癌的发生、发展和转移息息相关。传统外泌体检测方法的发展受限于其复杂和耗时的分离过程、纯化步骤和分析过程。GPC1(glypican-1)蛋白和EphA2(ephrin type-A receptor 2)蛋白是两种胰腺癌外泌体中过表达的膜蛋白。基于这两种特异性外泌体膜蛋白的肿瘤外泌体检测方法将有助于推动胰腺癌早期筛查的发展,实现超灵敏早期检测。近日,中国科学院硅酸盐研究所施剑林、胡萍和仁济医院胆胰外科刘颖斌在胰腺癌早期诊断领域取得突破,最新在国际权威学术期刊ACS NANO上发表题为“Dual Tumor Exosome Biomarker Co-recognitions Based Nanoliquid Biopsy for the Accurate Early Diagnosis of Pancreatic Cancer”的文章(doi: 10.1021/acsnano.3c00674)。该研究工作基于双生物标志物共识别,建立了一种新型纳米液体活检(nLB)检测方法用于胰腺肿瘤外泌体的超灵敏特异性检测。
与传统的胰腺癌诊断方法相比,该方法具有出色的特异性,通过构建EphA2抗体修饰的磁性纳米探针(Z-aE2)和GPC1抗体修饰的金纳米探针(Au-aG1)对胰腺癌肿瘤外泌体特异性识别与富集,双生物标志物特异性识别可避免其他类型外泌体的干扰,从而精准检出早期胰腺癌患者;其次,该方法通过 ICP-MS 将肿瘤外泌体表面GPC1蛋白的信号转化为Au元素浓度信号,实现了低至78 pg/mL的检测限,相比于传统 ELISA 法,nLB 检测方法表现出更大的线性范围(78 pg/mL~10,000 pg/mL)以及GPC1 与 Au 浓度之间良好相关性(R2=0.994)。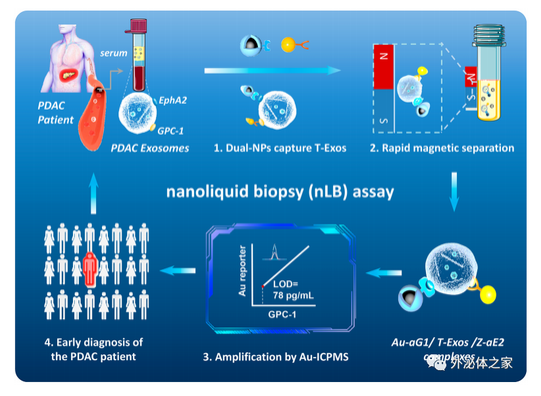
双生物标志物共识别肿瘤外泌体的纳米液体活检策略流程图临床上主要应用的非侵入性生物标志物是以 CA19-9 为代表的一些肿瘤抗原,作为评估患者,尤其针对早期胰腺癌患者的癌症进展具有局限性和滞后性。研究者评估了 nLB 策略对早期胰腺癌(I/II 期)患者和正常组的诊断能力,Au元素水平能够准确区分 I/II 期的PDAC 病例和正常组(AUC=1,敏感性和特异性为 100%),并展现出明显优于 ELISA 定量血清 GPC1(AUC =0.9848)和 CA19-9水平(AUC = 0.8658)的特点。这项研究在后续发展可针对其他肿瘤标志物进行精准化定制,提高临床转化的可行性和适应性。研究工作受国家自然科学基金等基金项目资助,构建的肿瘤外泌体检测方法已授权中国发明专利一项。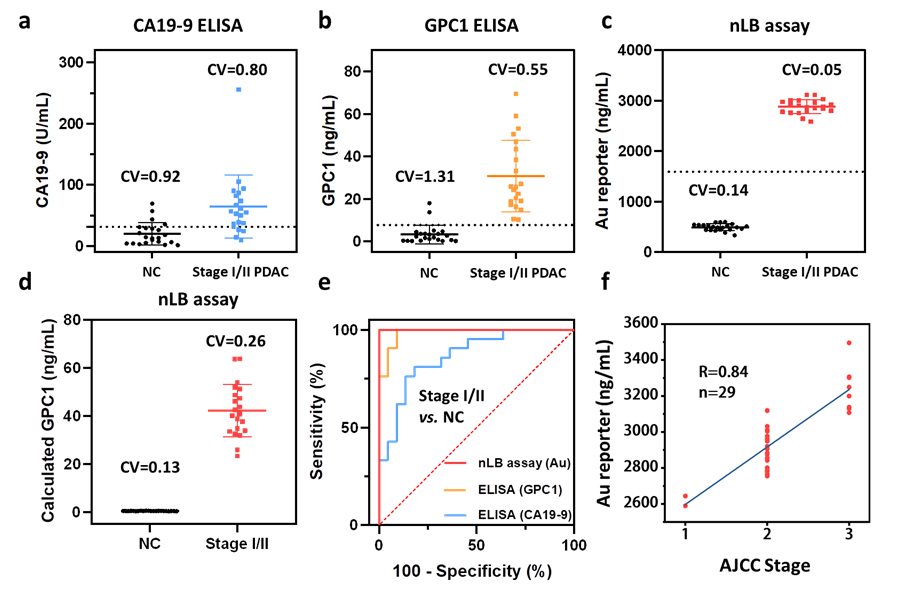
Dual Tumor Exosome Biomarker Co-recognitions Based Nanoliquid Biopsy for the Accurate Early Diagnosis of Pancreatic Cancer, ACS Nano. 2023 Jun 8. doi: 10.1021/acsnano.3c00674.外泌体资讯网 ACS NANO|双生物标志物共识别肿瘤外泌体的纳米液体活检策略用于胰腺癌早期诊断







