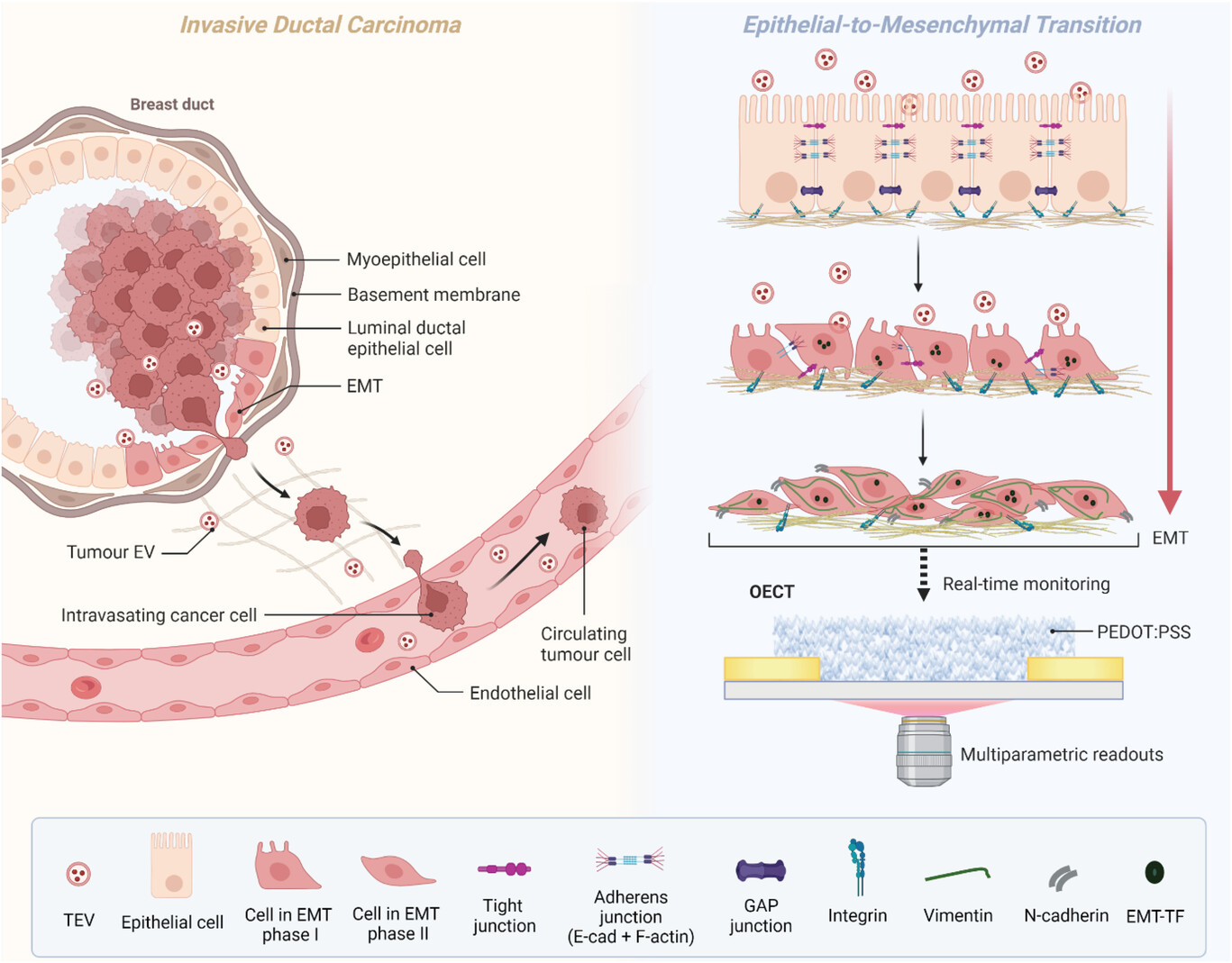
肿瘤源性细胞外囊泡(TEVs)在非恶性细胞中诱导上皮间质转化(EMT),促进肿瘤侵袭和转移,在目前严重缺乏有效抗转移治疗的领域中成为了一种新的治疗靶点。然而,目前尚缺乏可扩展的技术平台,可用于连续、多参数监测并用于筛选抗肿瘤转移的抑制剂或药物。来自英国剑桥大学的研究人员开发了一种基于有机生物电子技术的平台,实现了监测乳腺癌细胞来源的TEV驱动EMT的全过程,并用于EMT抑制剂的药物筛选和评价。相关内容以“Organic Electronic Platform for Real-Time Phenotypic Screening of Extracellular-Vesicle-Driven Breast Cancer Metastasis”为题于5月12日在线发表在国际材料学领域学术期刊Advanced Healthcare Materials杂志上。
根据世界卫生组织的数据,癌症是全球死亡的主要原因,癌症相关死亡的主要原因是广泛的转移。与此同时,药物开发是一个缓慢而昂贵的过程,美国食品和药物管理局(FDA)在肿瘤临床试验中批准的失败率为96.6%,主要原因是有效性或安全性问题。因此,开发可靠的临床前药物筛选技术和疾病模型是当务之急。虽然转移是肿瘤的一个标志,但人们对其了解甚少,部分原因是在表征肿瘤转移的空间和时间进展方面存在挑战。肿瘤细胞分泌的参与细胞间通讯的纳米颗粒,称为细胞外囊泡(EVs),在转移中起关键作用。肿瘤源性EV(TEV)携带具有致癌潜能的功能性生物分子,并在受体细胞中诱导恶性转化。TEV驱动上皮间质转化(EMT)的过程,这是转移的核心组成部分。EMT是一个可逆的过程,通过这个过程,肿瘤浸润前的上皮细胞获得间充质表型,并发展出通过循环迁移、侵袭和传播的能力,从而在远端器官形成转移灶。针对TEV进行治疗干预可能是预防EMT的新途径,从而预防肿瘤转移。通过基于细胞的疾病模型的表型进行药物发现,可能无法完全解决疾病的复杂性。传统的研究手段(如组学或显微镜成像等),很难反映药效学和药代动力学之间的时间关系,并定量用于转化为体内结果。此外,在药物发现的早期阶段,利用低通量技术筛选数千种潜在的靶点受成本和时间上的限制。因此,迫切需要将疾病相关的基于细胞的模型与新颖的、可扩展的传感技术相结合,这些技术可以产生无偏差的高含量和多参数读数,理想情况下是连续的,而不会破坏研究系统的原始状态。在这项研究里,研究人员提出了一个基于有机生物电子技术的平台,以满足这些要求。研究人员开发了一种基于有机电化学晶体管(OECTs)的功能表型筛选平台,用于实时、无创地监测TEV诱导的EMT进程,并用于筛选抗肿瘤转移药物。自从发现导电聚合物以来,有机电子学领域取得了巨大的进步,在生物医学研究中得到了广泛的应用。OECT是一个例子,已经与从质膜到3D复杂细胞培养的各种复杂的体外模型集成。OECT包括三端结构,包括导电聚合物通道两侧的源极和漏极,以及控制通道导电性的栅极。OECT属于更广泛的“电解质门控晶体管”类别,它与电解质直接接触,依赖于离子在栅极偏置的作用下被“推”到导电聚合物通道中,改变其掺杂状态,从而改变其导电性。因此,OECT被广泛认为是特别有前途的生物信号放大器,而不需要加入外部电路。聚(3,4-乙烯二氧噻吩):聚苯乙烯磺酸盐(PEDOT:PSS)因其优异的稳定性和易于加工而成为OECT的首选材料。当与水性生物环境接触时,PEDOT:PSS会膨胀,为细胞提供生物相容性的水凝胶样界面。PEDOT:PSS的另一个关键特征是其光学透明度,使其与显微镜兼容,从而实现同时的光学和电子读数,在生物分析中至关重要。基于PEDOT:PSS的OECTs已被用于监测细胞覆盖和分化,以及细胞直接粘附Transwell和其他设备表面的上皮屏障完整性。后者涉及通道和栅极上单层细胞的生长,这为电解质(细胞培养基)中的离子运动引入了屏障,直接影响晶体管输出,实际上使用OECT作为阻抗生物传感器。OECT在细胞培养物界面作为阻抗生物传感器,监测紧密连接调制、肾毒性、肿瘤侵袭、伤口愈合和毒理学已成功用于生物医学研究的各种应用领域,但迄今为止生物学范围有限。研究人员将OECT与基于细胞的EMT模型相结合,以解决当前传感技术面临的问题,并为基于有机电子的表型药物筛选提供概念。研究结果证明,OECT能够实时监测TEV诱导的EMT,来自三阴性乳腺癌细胞系MDA-MB-231的TEV在9天的时间内诱导非恶性乳腺上皮细胞(MCF10A)发生EMT,成功建立了浸润性导管癌转移模型。免疫印迹分析和免疫荧光成像证实TEV处理细胞的EMT状态,同时使用OECTs获得细胞表型的双光学和电学读数。此外,肝素是一种竞争性的细胞表面受体抑制剂,被认为是TEV诱导的EMT的有效阻滞剂。这些结果提供了TEV功能抑制剂具有抗转移候选药物潜力的证明,展示了该电子平台的药物筛选能力。参考文献:Organic Electronic Platform for Real-Time Phenotypic Screening of Extracellular-Vesicle-Driven Breast Cancer Metastasis. Adv Healthc Mater. 2023 May 12:e2301194.