心肌梗死是指因冠状动脉阻塞致心肌出现缺血性坏死的疾病,促进心梗周边区生成新生血管,能有效延长受损心肌的存活,改善梗死后心室重构和心脏功能,是治疗心肌梗死的重要策略之一。内皮祖细胞(EPCs)衍生的细胞外囊泡(EVs)可携带蛋白质、细胞因子和miRNA等多种生物活性物质,通过旁分泌途径支持梗死区内皮细胞,是血管再生的关键参与者。然而,由于骨髓及循环中归巢至梗死区的EPCs数量有限,且现有体外提取外泌体的方法效率低下,费用昂贵,极大地限制了EPC-EVs 的临床应用。因此,寻找能增强外泌体产量、质量,减少其治疗量的方法对于外泌体治疗效果的提升及临床应用具有重要意义。
2023年4月13日,南方医科大学东莞市人民医院区彩文教授和中国科学院大学温州研究院常江教授团队在Nature Communications发表了题为“Extracellular vesicles engineering by silicates-activated endothelial progenitor cells for myocardial infarction treatment in male mice”的研究论文(2023 Apr 13;14(1):2094),揭示了硅酸盐离子(CS)在调节EPCs分泌高生物活性细胞外囊泡中的分子机制,及由水凝胶微球负载的高生物活性细胞外囊泡在心肌梗死后心脏修复中的作用,为相关疾病的治疗提供了新的思路。
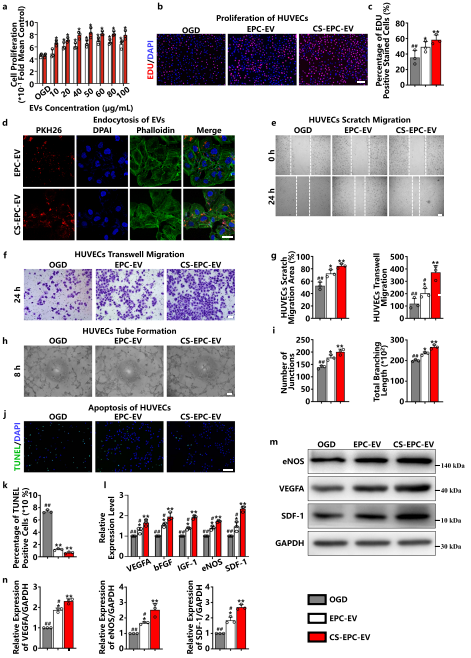
为了评估CS-EPC-EVs能在糖氧剥夺条件下HUVECs血管生成能力,作者采用划痕实验和Transwell实验评价不同细胞外囊泡对糖氧剥夺条件下HUVECs体外迁移的影响,用小管成型实验、Tunnel实验评价其对糖氧剥夺条件下HUVECs体外管腔形成及抗凋亡能力的影响,结果显示,CS-EPC-EVs比EPC-EVs具有更好的血管生成能力。此外,Qpcr试验和WB试验证实,CS-EPC-EVs可以更显著增强体外HUVECs的促血管生成相关基因的表达水平。
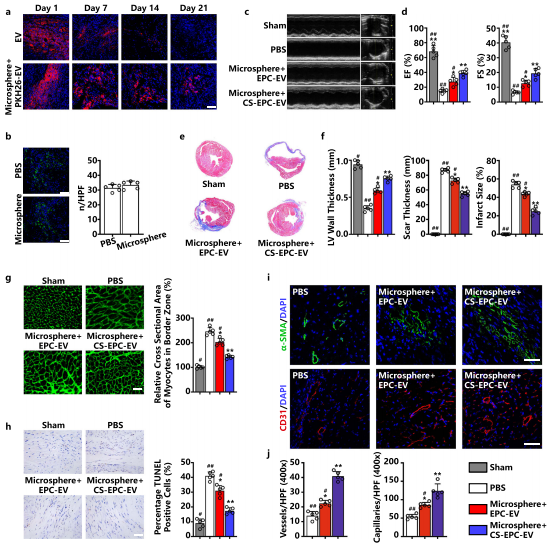
基于体外实验,作者推测CS-EPC-EVs对心梗的治疗效果可能优于EPC-EVs。为了明确CS-EPC-EVs在心肌梗死心脏修复中的作用,作者对小鼠冠状动脉左前降支进行了永久性结扎,以模拟人类心肌梗死。并通过微流控技术制备了负载EVs的GelMA-PEG微球(Microsphere),实现在梗死区的持续递送。作者发现,超声心动图、Masson染色、麦胚凝集素染色、TUNEL染色等一系列实验结果证实,Microsphere+CS-EPC-EVs可改善心肌梗死后的心功能,减轻心脏重构、抑制心肌细胞凋亡,并增强心肌梗死缺血区EPCs的募集,从而积极促进梗死部位的血管生成。
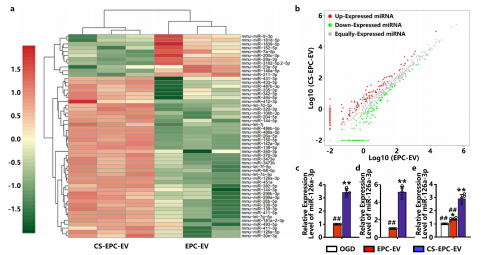
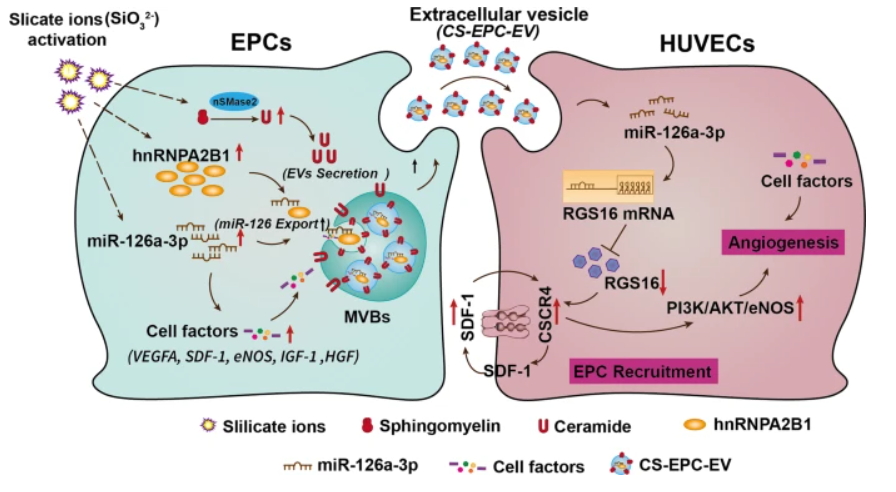
为了进一步探究CS-EPC-EVs治疗作用的潜在机制,作者使用高通量测序分析了EPC-EVs与CS-EPC-EVs的差异性miRNA表达谱,发现硅酸盐离子可以提高EPCs及其衍生的外泌体内miR-126a-3p的表达,且CS-EPC-EVs可通过转移高表达的miR-126a-3p来促进HUVECs的血管生成,并通过进一步研究证实,miR-126a-3p在EV中的分选是由hnRNPA2B1和nSMase2介导的。
作者认为,激活EPCs分泌高生物活性细胞外囊泡的潜在机制可能与硅酸盐离子可刺激EPCs表达高水平的nSMase2、hnRNPA2B1和miR-126a-3p有关。其中,nSMase2可导致细胞中神经酰胺分泌增加,促进细胞外囊泡的产生,hnRNPA2B1可选择性地增强miR-126a-3p的分选,促进细胞外囊泡中miR-126a-3p及血管生成因子的含量增加。当将携带有高含量miR-126a-3p和血管生成因子的高生物活性细胞外囊泡应用于心肌梗死边缘区时,高生物活性细胞外囊泡可通过激活HUVECs中的SDF-1 / CXCR4轴及其下游PI3K / AKT / eNOS轴以刺激血管生成。
综上所述,作者证明了硅酸盐离子可以有效刺激EPCs分泌高产高生物活性的细胞外囊泡,并且证实了由水凝胶微球负载的高生物活性细胞外囊泡可以有效促进心肌梗死后心脏修复。
南方医科大学珠江医院康复科余彬、心内科李和慨医师,以及中国科学院大学温州研究院博士后张赵文斌博士为该文章共同第一作者,南方医科大学东莞市人民医院区彩文教授和中国科学院大学温州研究院常江教授为共同通讯作者,并得到中国科学院战略重点研究计划、国家自然科学基金等经费资助。
参考文献:
Extracellular vesicles engineering by silicates-activated endothelial progenitor cells for myocardial infarction treatment in male mice, Nat Commun. 2023 Apr 13;14(1):2094. doi: 10.1038/s41467-023-37832-y.
外泌体资讯网 Nat Commun|南方医科大学区彩文/中国科学院大学常江教授团队联合揭示硅酸盐离子调节内皮祖细胞分泌高活性细胞外囊泡治疗心肌梗死的作用机制