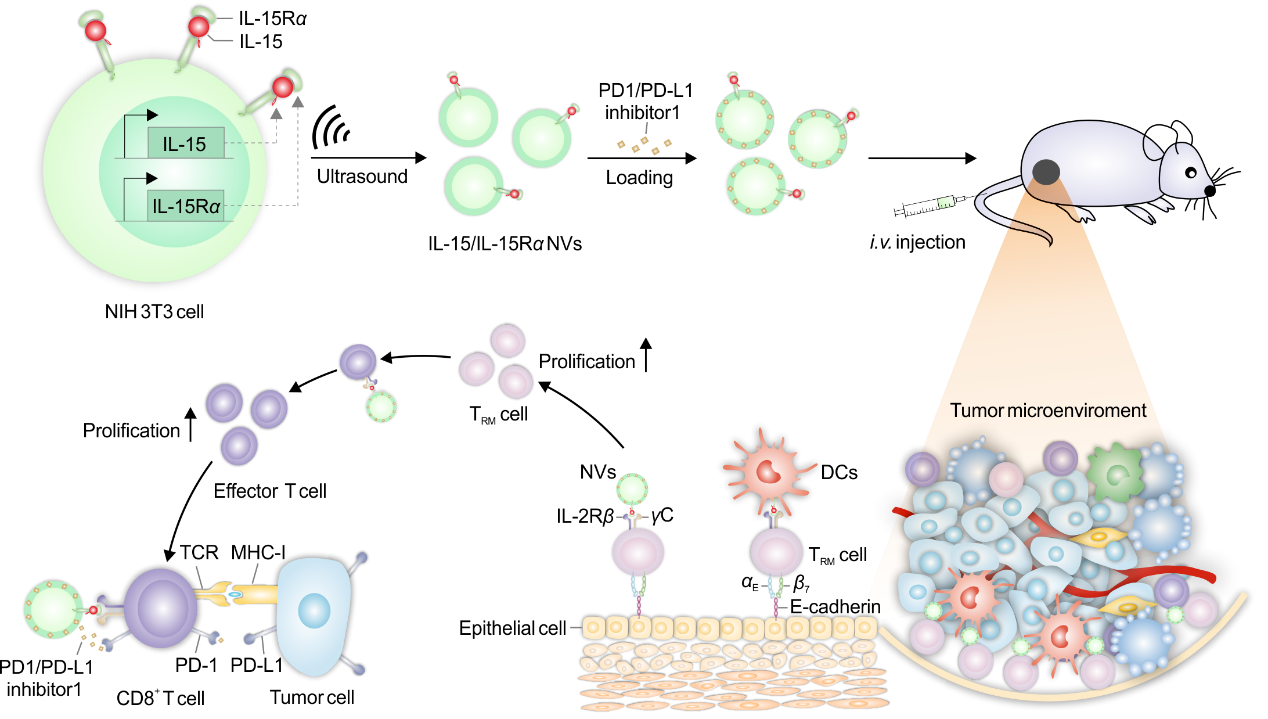
近日,中山大学医学院张旭东副教授课题组与张幸鼎教授课题组合作在美国细胞外囊泡学会官方期刊Extracellular Vesicle发表了题为“Engineered IL-15/IL-15Rα-expressing cellular vesicles promote T cell anti-tumor immunity”的研究论文。研究团队利用基因工程在细胞外膜上稳定表达IL-15/IL-15Rα复合物,进而制备表达IL-15/IL-15Rα复合物的工程化膜囊泡,联合使用免疫检查点抑制剂(ICI),开发新型肿瘤免疫治疗药物制剂。
肿瘤特异性T细胞在体内癌细胞的清除过程中具有重要作用。然而,大多数效应T细胞在履行职责后很快发生凋亡。T细胞凋亡避免了T细胞聚集引起自身免疫攻击的风险,却不利于抗肿瘤疗效。中央记忆T(TCM ) 细胞和效应记忆 T (TEM) 细胞可以在小鼠体内持续存在数月或在人体内持续存在数十年,保护宿主免受肿瘤复发的挑战。组织驻留记忆 T (TRM) 细胞可以在实质组织中引发免疫监视和免疫保护反应:当宿主再次受到肿瘤抗原攻击时,TRM 细胞被诱导增殖,分化为 T 效应细胞或直接攻击肿瘤细胞。已有研究证实,肿瘤中 TRM 细胞的丰度与黑色素瘤、乳腺癌和其他类型癌症患者的总生存期呈正相关。因此,增强临床上对效应T细胞、TRM细胞活性、功能的免疫调节能力,对于开发新的肿瘤免疫治疗药物制剂有重要意义。IL-15 是一种多效性细胞因子,能够调节多种免疫细胞的存活、增殖和功能,并能放大T细胞的免疫反应。在实体瘤的免疫微环境中,IL-15与淋巴细胞活化密切相关,能够维持 TRM 细胞并限制实体瘤的进展。IL-15 的缺乏可能导致 CTL 功能障碍,无法发挥其杀死肿瘤细胞的作用。目前,IL-15 被认为是一种潜在的治疗性免疫调节激动剂。然而,临床前IL-15 的反应受到体内半衰期短、生物利用度低和肿瘤靶向性不足的限制。尽管如此,通过增加使用量来解决这个问题并不是一个可行的方法,因为不受控制的高剂量 IL-15 可以增强促炎细胞因子的表达,如 IL-4、IL-6、IFN-γ 和 TNF-α , 导致全身毒性和限制。因此,如何提高IL-15的治疗反应,减少癌症治疗的临床副作用仍是个挑战。细胞来源的膜囊泡在药物递送方面具有巨大潜力。膜囊泡具有循环稳定性、低免疫原性和良好的体内生物相容性。此外,质膜囊泡部分继承了原始细胞的某些功能,因此可以被用作化学疗法和免疫疗法的药物载体。表达受体、配体抗体的基因工程质膜囊泡通常具有与纯质膜囊泡相比的特定功能。工程化膜囊泡在靶向药物递送、诊断和免疫治疗等应用方面具有优良的潜力。
图1. IL-15/ IL-15Rα NVs的制备及联合PD-1/PD-L1抑制剂的免疫增强作用
(i) 在NIH 3T3细胞株的细胞膜上稳定表达IL-15/IL-15Rα复合物;(ii) 通过超速离心、挤压获得IL-15/IL-15Rα NVs;(iii) IL-15/ IL-15Rα NVs促进肿瘤特异性细胞的激活和增殖;(iv) 将PD-1/PD-L1 inhibitor 1载入IL-15/IL-15Rα NVs,共同激活CD8+T细胞,阻断肿瘤细胞对细胞的抑制作用。TCR:T细胞受体;MHC-I:主要组织相容性复合体I
基于以上研究背景,张旭东副教授团队通过基因工程手段使IL-15/IL-15Rα共表达并定位在细胞膜囊泡上,进而增强肿瘤微环境中T淋巴细胞抗肿瘤能力。研究人员首先利用基因工程手段,使IL-15/IL-15Rα稳定表达在NIH 3T3细胞膜上,再通过超速离心、挤压等方法制备了表达IL-15/IL-15Rα的细胞外囊泡(IL-15/IL-15Rα NVs)。进而将PD-1/PD-L1抑制剂(PD-1/PD-L1 inhibitor 1)装载进入IL-15/IL-15Rα NVs,制备联合治疗剂(IL-15/IL-15Rα NVs-PD-1/PD-L1 inhibitor 1)。体外实验表明,IL-15/IL-15Rα NVs可稳定结合至CTLL-2细胞膜表面,促进其增殖活化。在建立的小鼠黑色素瘤肿瘤模型中,接受IL-15/IL-15Rα NVs治疗的小鼠可以有效延迟肿瘤生长。联合使用PD-1/PD-L1抑制剂可进一步增强抗肿瘤反应,抑制肿瘤生长,提高小鼠生存率。IL-15/IL-15Rα NVs-PD-1/PD-L1 inhibitor 1在体内可有效促进CD8+T细胞和TRM细胞的增殖、活化,防止T细胞的耗竭,从而提高小鼠的抗肿瘤能力。综上所述,细胞膜囊泡可以作为治疗性白介素药物的良好载体,显著增强抗肿瘤免疫反应;该研究为癌症免疫治疗药物制剂的开发提供了思路,具有较大的应用转化潜力。
该研究论文第一完成单位为中山大学医学院。中山大学医学院张旭东副教授、张幸鼎教授和广东医科大学基础医学院梁欣博士为论文的共同通讯作者。中山大学医学院博士生方文丽、研究生李丽艳和林仲达为共同第一作者。这项工作得到了国家自然科学基金,广东省自然科学基金,深圳市优秀科技创新人才培养项目(优青项目),深圳市基础研究重点项目等的支持。
参考文献:
Engineered IL-15/IL-15Rα-expressing cellular vesicles promote T cell anti-tumor immunity, Extracellular Vesicle, 2023, 2,10021.
https://doi.org/10.1016/j.vesic.2022.100021
Extracellular Vesicle (Elsevier)是细胞外囊泡研究转化领域著名科学家Raghu Kalluri(Codiak BioSciences科学创始人)主创,由美国细胞外囊泡协会 (AAEV)和爱思唯尔出版公司共同创办的一本主打细胞外囊泡相关研究的英文新刊,同时也是美国细胞外囊泡协会的官方期刊。期刊以细胞外囊泡为中心,聚焦细胞外囊泡相关基础研究、产业转化及临床应用三大研究领域,旨在打造为细胞外囊泡领域综合性顶级期刊。
更多详细信息,请访问Extracellular Vesicle (Elsevier)杂志主页。
https://www.journals.elsevier.com/extracellular-vesicle
外泌体资讯网 中山大学张旭东/张幸鼎Extracellular Vesicle:工程化细胞膜囊泡表达IL-15增强T细胞抗肿瘤免疫