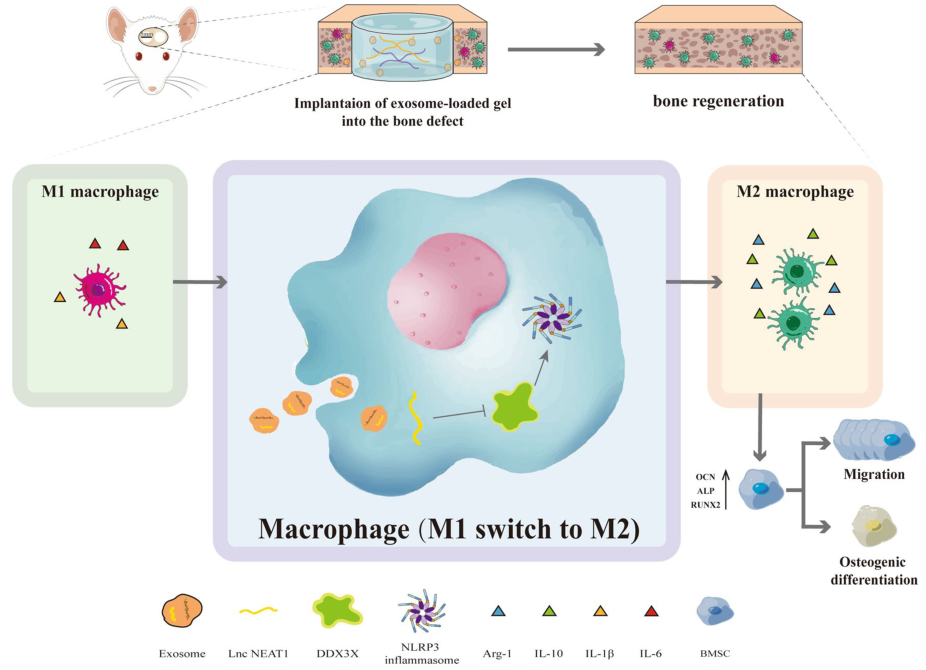
骨缺损的修复是一个复杂的过程,缺损处的免疫炎症反应与新骨再生之间存在着密切的相互关系。巨噬细胞在免疫炎症反应过程中十分重要。外泌体是细胞间传递信息的信使,其中的LncRNA发挥着十分重要的作用。然而,人脐静脉内皮细胞(HUVECs)衍生的外泌体中LncRNA调节巨噬细胞极化,促进骨修复的潜在机制尚不明确 。
近日,华中科技大学同济医学院附属协和医院整形外科安然、王介聪教授团队在期刊Journal of Nanobiotechnology上发表了题为“Exosomal Lnc NEAT1 from endothelial cells promote bone regeneration by regulating macrophage polarization via DDX3X/NLRP3 axis”的研究论文(2023 Mar 20;21(1):98)。该研究阐明了HUVECs外泌体中的LncRNA NEAT1可通过DDX3X/NLRP3轴调控巨噬细胞M2极化并进一步促进骨再生。华中科技大学同济医学院附属协和医院整形外科硕士研究生陈宇轩为该论文第一作者。
骨缺损的修复是一个复杂的过程,缺损处的免疫炎症反应与新骨再生之间存在着密切的相互关系。巨噬细胞在免疫炎症反应过程中十分重要。外泌体是细胞间传递信息的信使,其中的LncRNA发挥着十分重要的作用。
研究者发现,在体内,HUVECs来源外泌体(Exos)可部分逆转LPS诱导的巨噬细胞M1极化,促进其向M2方向极化并分泌更多的抗炎细胞因子。除此之外,使用Exos处理过后的巨噬细胞条件培养基显著增强了骨髓间充质干细胞的成骨及迁移能力。在体外,Exos可缓解小鼠air pouch模型中的气囊炎症,并促进大鼠颅骨缺损的修复。当使用从敲除NEAT1的HUVEC获取的外泌体(si-Exos)时,上述抗炎及促组织修复效果均显著减弱。在机制方面,证实了NEAT1可通过DDX3X/NLRP3轴调控NLRP3炎症小体相关通路的表达情况。
综上,研究表明HUVECs衍生的外泌体可以通过 NEA T1调控DDX3X/NLRP3轴,诱导巨噬细胞M2极化从而减轻炎症反应,促进骨再生,为骨组织工程的研究提供了新的思路。
参考文献:
Exosomal Lnc NEAT1 from endothelial cells promote bone regeneration by regulating macrophage polarization via DDX3X/NLRP3 axis. J Nanobiotechnology. 2023 Mar 20. doi: 10.1186/s12951-023-01855-w.
外泌体资讯网 J Nanobiotechnology|华中科技大学安然/王介聪:内皮细胞外泌体Lnc NEAT1通过调节巨噬细胞极化促进骨再生





