细胞外囊泡由生命各个领域的物种产生,这表明囊泡形成代表了生命物质的基本原理。在革兰氏阴性菌中,膜囊泡(MV)可源自外膜泡或内溶素触发的爆炸性细胞裂解,后者通常由基因毒性应激诱导。尽管对革兰氏阳性和革兰氏中性细菌的囊泡形成机制知之甚少,但最近的研究表明,裂解和起泡机制也存在于这些生物体中。过去几年积累的证据表明,不同的生物发生途径导致具有不同结构和组成的不同类型的MV。这篇评论讨论了不同类型的MV及其潜在的货物包装机制。总结了有关MV组成如何决定其各种功能的当前知识,包括通过废物处理支持细菌生长、营养物清除、生物活性分子的输出、DNA转移、噬菌体的中和、抗生素和杀菌功能、毒力因子和毒素的传递对宿主细胞以及炎症和免疫调节作用。还讨论了MV介导的分泌与经典细菌分泌系统相比的优势,并介绍了量子分泌的概念。
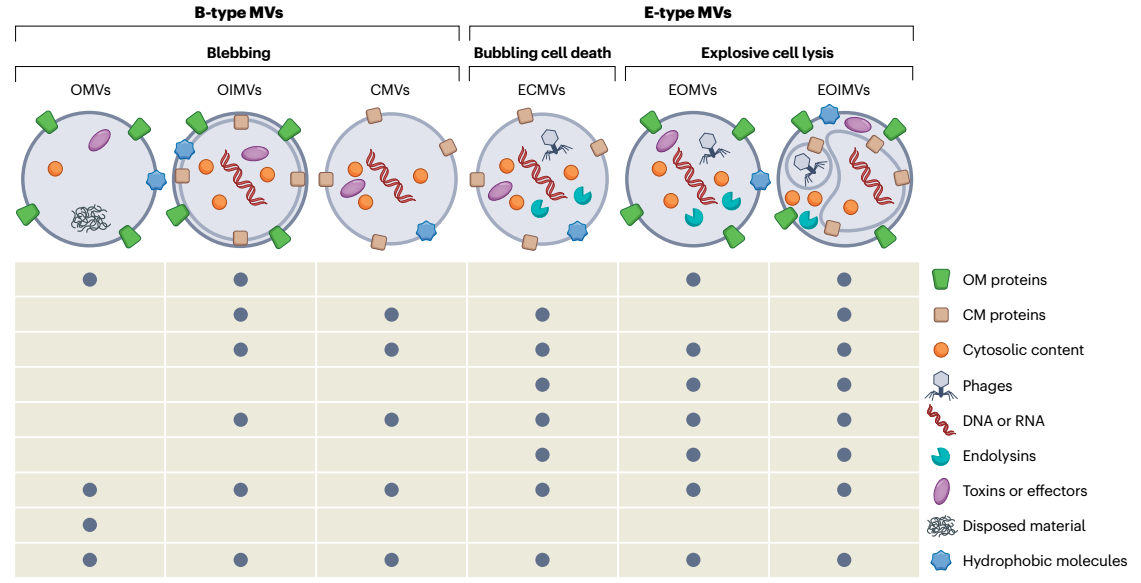
图1、具有不同结构和组成的膜囊泡类型具有不同的生物发生途径。革兰氏阴性细菌通过外膜(OM)的起泡或通过爆炸性细胞裂解产生膜囊泡(MV)。由细胞包膜紊乱引起的OM起泡,例如不平衡的肽聚糖生物合成、变性蛋白质的积累或疏水分子嵌入OM导致外膜囊泡(OMV)的产生。因此,OMV货物没有细胞质成分,但富含周质蛋白和OM成分。外-内MV(OIMV)由起泡机制形成,该机制始于自溶素削弱细菌肽聚糖层,随后内膜突入周质。然后细胞质内容物进入囊泡,囊泡最终与周围的OM一起从细胞表面夹断。由爆发性细胞裂解介导的囊泡产生是由噬菌体衍生的细胞内溶素触发的,该细胞内溶素降解细胞的肽聚糖层。然后细胞变圆、爆炸,破碎的膜碎片自退火形成爆炸性外-内膜囊泡(EOIMV)和爆炸性外膜囊泡(EOMV)。与OMV相比,这些E型囊泡含有细胞溶质成分,包括基因组DNA。内溶素还通过触发起泡细胞死亡促进革兰氏阳性细菌的囊泡产生,通过裂解(ECMV)产生细胞质膜囊泡。ECMV也可以由于应激诱导的革兰氏阳性细菌自溶或由于外源性细胞内溶素或抑制肽聚糖生物合成的抗生素水解肽聚糖而形成。这些细胞质膜囊泡(CMV)不携带细胞内溶素(未显示)。在金黄色葡萄球菌中,CMV也可以通过起泡机制形成,该机制涉及苯酚可溶性调节蛋白破坏细胞质膜,以及随后在自溶素削弱肽聚糖交联后通过细胞壁释放CMV。
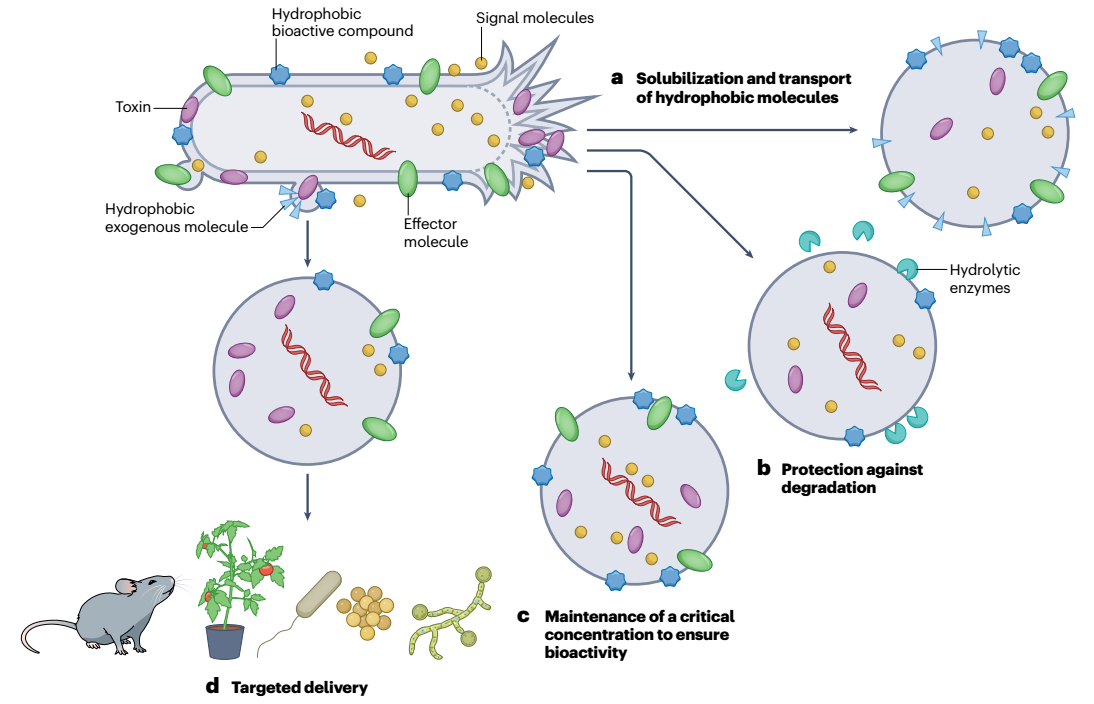
图2、膜囊泡货物运输和递送。a,溶解性差的疏水性分子可以分散,并可能通过膜囊泡(MV)在水性系统中长距离运输。b,管腔内容物和膜包埋分子受到保护,不会被水解酶和不利的物理化学条件降解。c,MV可以浓缩生物活性成分,使得单个MV与其靶细胞的融合可以直接递送足够量的分子以确保其生物活性,这种现象称为量子分泌(也参见图3)。d,MVs可能偏好与某些类型的细胞特异性融合,从而允许有针对性的MV货物递送。这些特征适用于独立于其生物发生途径的所有囊泡类型,因此没有描述特定的MV类型,或仅归因于这些功能。然而,不同MV类型的货物因其生物发生途径而异。尽管所示示例基于革兰氏阴性菌产生的MV,但货物输送的大多数优势也适用于革兰氏阳性菌形成的CMV。
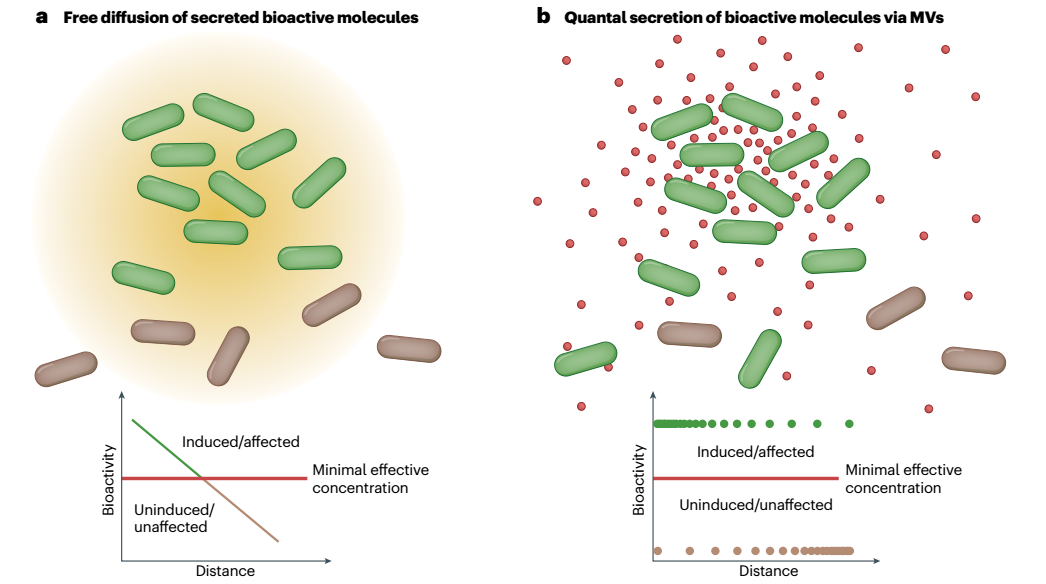
图3、膜囊泡作为量子传递系统。a,由于扩散到周围环境中,经典运输系统分泌的生物活性分子的浓度随着与生产细胞的距离增加而迅速降低。低于某个最低有效浓度,该化合物将不再显示生物活性。该阈值浓度反映了信号分子用于细胞间通讯的呼叫距离或抗菌化合物情况下的最小抑制浓度。重要的是,由于存在生物活性分子的梯度,相邻细胞将暴露于不同水平的化合物,因此会受到不同的影响。b,借助膜囊泡(MV)释放的生物活性分子不仅不受降解的保护,因此可能能够长距离传播,而且还被浓缩,使得单个MV与其靶细胞融合足以递送高于最小有效浓度的剂量。结果,形成了两个不同的细胞群,即诱导或受影响的细胞和未诱导或未受影响的细胞。虽然MV的浓度会随着距离的增加而降低,但高浓度将确保即使是非常远的细胞也能被完全影响。
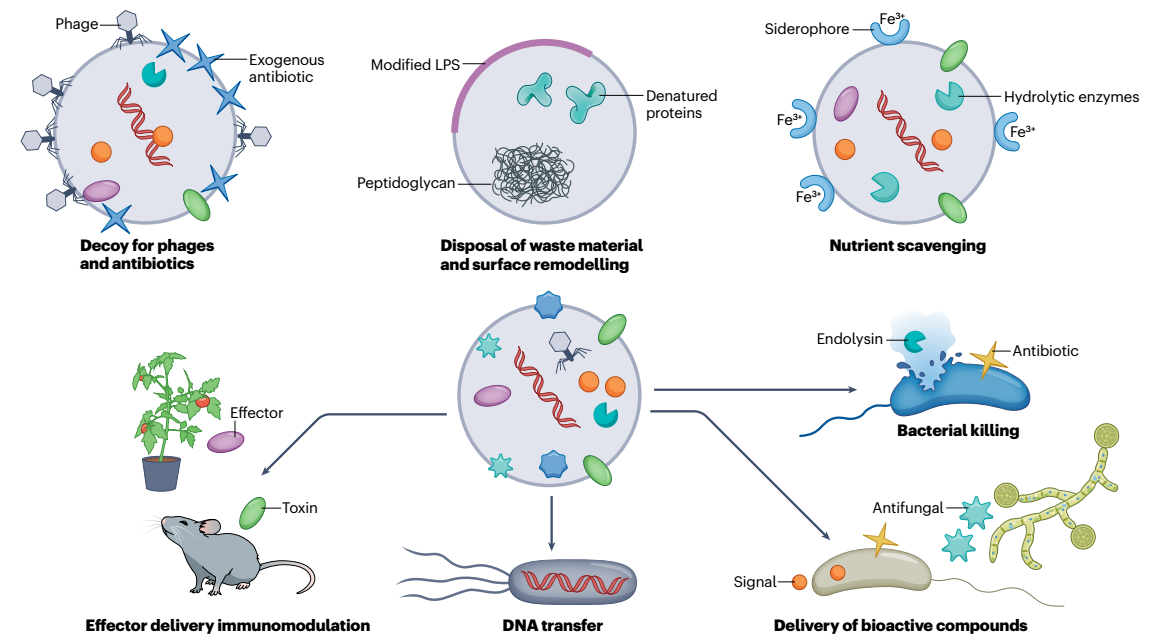
图4、膜囊泡具有多种生物学功能。几种功能可能与所有膜囊泡(MV)相关,例如噬菌体失活、外部添加的抗生素的中和、营养物获取和细菌杀灭(通过富含B型MV的抗生素化合物和富含E型MV的细胞内溶素)。某些功能可能更特定于特定的MV类型。例如,外-内MV和E型MV将优先转移DNA。同样,与许多细菌一样,毒素的表达和MV的形成由SOS反应协调;E型MV对于与真核生物的相互作用和宿主免疫调节可能特别重要。相反,变性蛋白质、肽聚糖和改性脂多糖(LPS)的处理似乎对外膜(OM)囊泡具有特异性,这些囊泡是在这些分子的积累上形成的。尽管原则上所有类型的囊泡都可以结合和运输疏水化合物,但这些可能特别常与OM囊泡相关,OM囊泡可以通过将疏水化合物嵌入OM中形成。外源性抗生素(蓝星)是指添加到培养物中并被MV中和的任何抗生素(例如膜靶向抗生素)。由细菌产生并通过MV释放的抗生素用黄色星号表示。
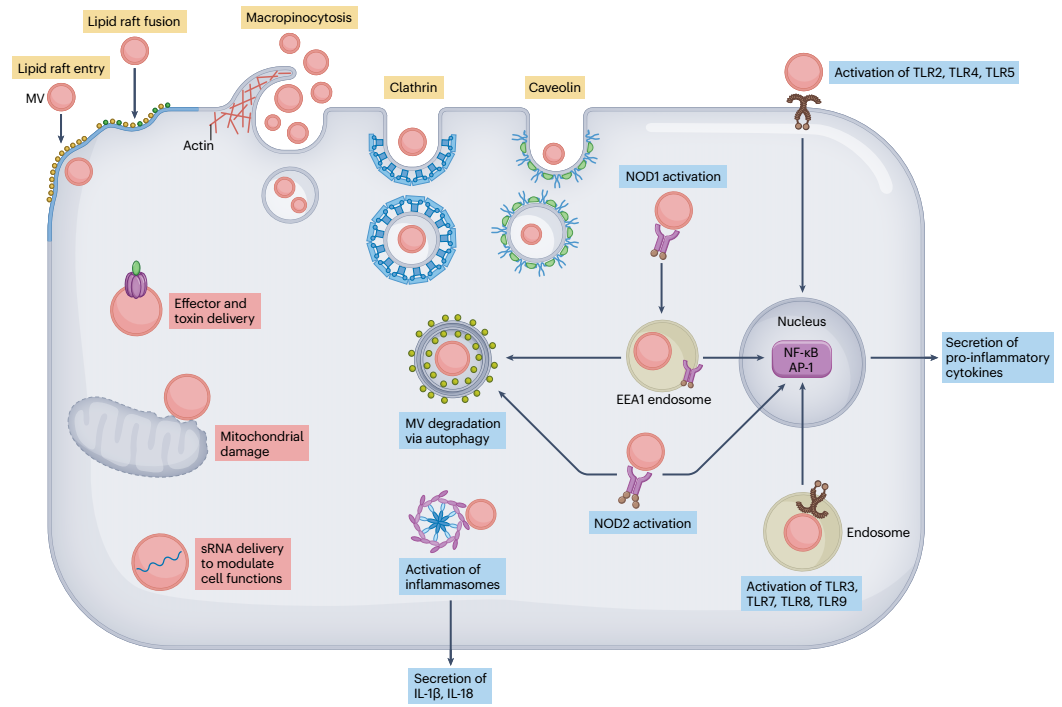
图5、细菌膜囊泡进入宿主细胞以调节免疫力和介导发病机制。膜囊泡(MV)可以通过一系列机制进入非吞噬宿主细胞,包括通过脂筏进入、与脂筏融合或通过微胞饮作用、网格蛋白介导或小窝蛋白介导的内吞作用(用黄色文本框表示)进入。一旦进入宿主细胞,MV就可以通过从其亲本细菌传递细菌效应子和免疫调节小RNA(sRNA)或通过介导线粒体损伤(用红色文本框表示)来调节宿主免疫力。MV及其货物可以被宿主先天免疫受体检测到,从而导致促炎反应的诱导(由蓝色文本框表示)。这包括表面和内体结合的Toll样受体(TLR)的激活、细胞质核苷酸结合寡聚化结构域蛋白1(NOD1)和2(NOD2)受体的激活以及炎性体的激活,它们共同导致生产促炎细胞因子和趋化因子。一旦进入宿主细胞,MV就会被宿主细胞降解自噬途径清除。
细菌膜囊泡(MV)从广泛的微生物物种中分泌出来,并将其内容物转移到其他细胞。尽管MV在细菌通讯中起着关键作用,但MV是否选择性地与微生物群落中的细菌细胞相互作用尚不清楚。细菌膜囊泡(MV)是源自细菌膜成分的纳米颗粒,可运输微生物衍生物质。MV在各种陆地和海洋环境中无处不在,并且其组成和功能差异很大。MVs可以传递破坏性的毒力因子,改变微生物群的组成,参与生物膜的形成,协助营养物质的吸收,并作为细菌的化学废物清除系统。MV还促进宿主与微生物的相互作用,包括交流。某些生长条件可能有利于某些MV生物发生途径,MV制剂通常是异质的,并且包含来自起泡和裂解的MV。该领域的主要挑战将是流式细胞术技术的改进以及分离和隔离不同MV类型以确定其组成和分析其功能的新方法的开发。一旦我们清楚地了解所有MV类型的特征,就有可能确定某些MV类型是否在特定环境生态位或临床样本中占主导地位。这不仅可以阐明细菌在特定栖息地所经历的条件,还可以让我们得出关于自然界中不同MV类型的功能的结论。
参考文献:
Toyofuku M, Schild S, Kaparakis-Liaskos M, Eberl L. Composition and functions of bacterial membrane vesicles. Nat Rev Microbiol. 2023 Mar 17. doi: 10.1038/s41579-023-00875-5. PMID: 36932221.
外泌体资讯网 Nature子刊综述:细菌膜囊泡的组成和功能