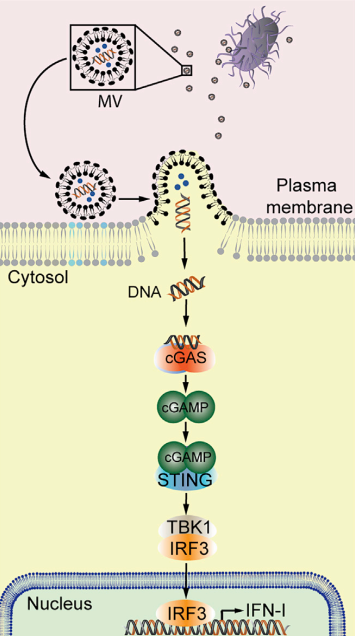
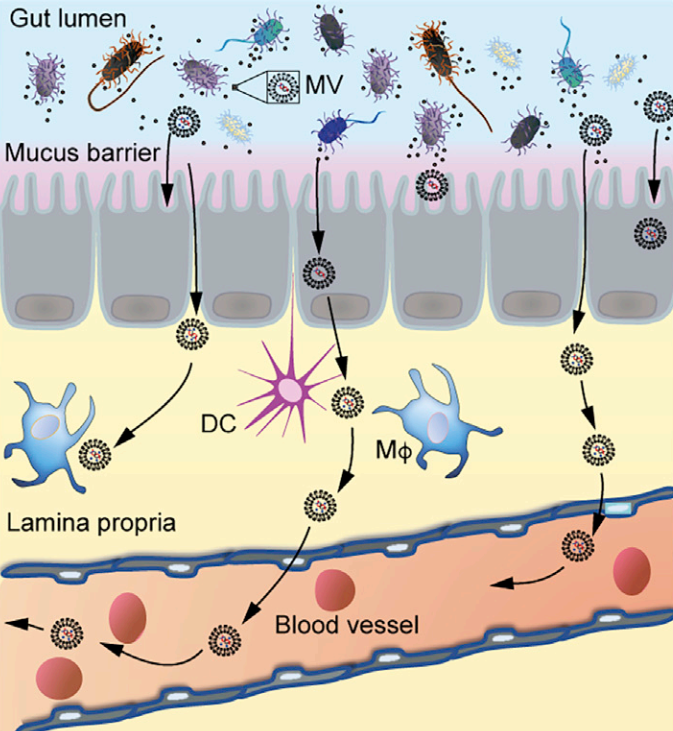
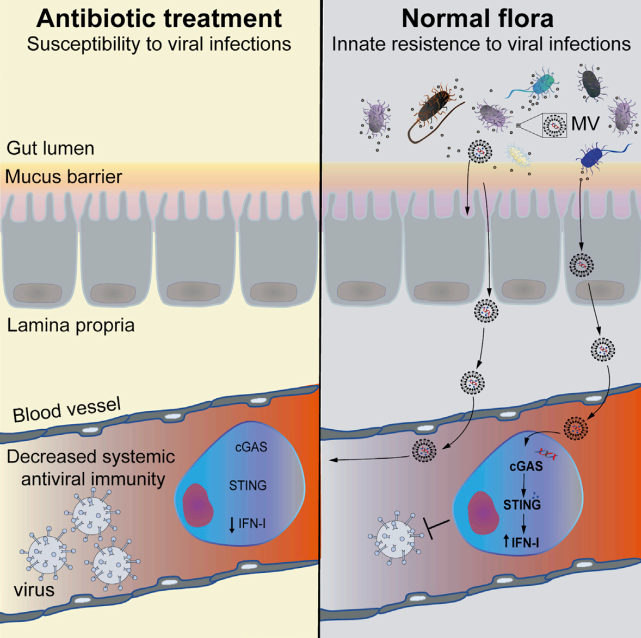
微生物群对于宿主免疫稳态至关重要。近日,来自瑞典斯德哥尔摩大学的研究人员在Immunity杂志上发表文章,报道了肠道微生物群通过细胞外囊泡调节全身免疫和对病毒感染的反应。
所有多细胞生物的屏障表面不断地被共生微生物所占据,这些微生物也被称为影响许多宿主生理过程的微生物群。其中绝大多数是驻留在肠道内的专性细胞外细菌。这些微生物对免疫系统的发育和成熟至关重要,并通过在营养物或附着位点上与这些病原体竞争并产生抗菌物质,从而为宿主提供对抗细菌和真菌病原体的保护。然而,微生物群如何影响病毒感染仍然是个谜。根据具体情况,它们可以促进或防止病毒入侵。I型干扰素(IFN-Is)对抗病毒免疫至关重要。尽管在感染期间产生大量IFN-Is,但也以稳定状态产生,尽管水平较低。这些基础IFN-Is对于维持免疫系统处于持续警觉状态以对感染和其他危险信号做出强有力的反应至关重要。IFN-Is主要通过三个先天免疫受体家族诱导:血浆/内体膜定位的Toll样受体(TLR)、感知RNA的细胞内Rig-I样受体(RLR)和环状GMP-AMP合成酶(cGAS),用于检测细胞质中的微生物DNA或错位的自身DNA。通常,假设这些受体的亚细胞定位决定了它们识别的微生物类别。细胞表面受体(例如TLR)感知细胞外微生物,而胞浆RLR和cGAS感知细胞内病原体(例如在细胞内复制的病毒)的存在。在过去的几十年中,越来越多的文献表明微生物群在IFN-I引发中的作用。迄今为止,了解微生物群如何启动IFN-I系统的努力主要集中在TLR的作用上,但得出了相互矛盾的结论。例如,尽管最近将微生物群驱动的IFN-I引发归因于由细菌糖脂触发的TLR4,但其他人将此归因于细菌代谢物对TLR7的激活,并且发现包括TLR4在内的其他几个TLR没有作用。相比之下,在另一项研究中,发现TLR的常见接头蛋白的抑制不会导致基础IFN-Is的减少。因此,与宿主感知微生物群和IFN-I启动有关的先天免疫受体仍然不清楚。此外,宿主屏障表面的这些专性细胞外微生物如何与远端免疫细胞交流以介导全身免疫调节尚未解决。该研究使用一系列新的遗传小鼠模型,对参与IFN-I启动的先天免疫途径进行了全面评估。研究发现,肠道微生物群对IFN-I系统的启动涉及细胞溶质cGAS-STING通路的强直激活,这对于先天抵抗DNA和RNA病毒感染的抵抗力至关重要。这种微生物群驱动的cGAS-STING-IFN-I轴激活不需要直接的宿主-细菌相互作用,而是通过膜囊泡介导的将细菌DNA递送到远端宿主细胞中远程发生。细胞外细菌介导的cGAS-STING-IFN-I轴激活模型肠道微生物群的抗生素抑制减少了全身性强直I型干扰素(IFN-I)和抗病毒启动。微生物群驱动的强直性IFN-I反应依赖于cGAS-STING,但不依赖于TLR信号传导或直接的宿主-细菌相互作用。来自细胞外细菌的膜囊泡(MVs)通过将细菌DNA递送到远端宿主细胞中来激活cGAS-STING-IFN-I轴。在循环中发现了来自肠道微生物群的含有DNA的MV,并以cGAS依赖性方式促进DNA(1型单纯疱疹病毒)和RNA(水疱性口炎病毒)病毒的清除。描述肠道微生物群如何脱落MVs以及这些MVs如何进入血液循环以诱导全身cGAS-STING-IFN-I启动的示意图该研究确立了微生物群在外周cGAS-STING激活中的重要作用,从而促进宿主对全身性病毒感染的抵抗力。此外,该研究说明在病毒感染期间使用抗生素的风险被低估了,在病毒感染的情况下可能需要谨慎使用抗生素。微生物群以尚未完全了解的方式影响全身免疫。该研究表明从肠道微生物群中释放膜囊泡导致细菌DNA系统性地输送到宿主细胞。这触发了细胞溶质cGAS-STING-IFN-I轴的强直激活,保护远端器官免受病毒感染。- 微生物群驱动的IFN-I启动涉及cGAS-STING轴;
- 微生物群通过含DNA的膜囊泡介导全身性IFN-I引发。
NatureReviews Immunology杂志对Immunity这篇研究报道进行了highlight推荐。ErttmannSF, Swacha P, Aung KM, Brindefalk B, Jiang H, Härtlova A, Uhlin BE, Wai SN,Gekara NO. The gut microbiota prime systemic antiviral immunity via thecGAS-STING-IFN-I axis. Immunity. 2022 May10;55(5):847-861.e10. doi: 10.1016/j.immuni.2022.04.006. PMID: 35545033.FlemmingA. Gut commensals promote antiviral immunity via extracellular vesicles.Nat Rev Immunol. 2022 May 24. doi:10.1038/s41577-022-00743-y. Epub ahead of print. PMID: 35610311.外泌体资讯网 Immunity:肠道微生物群通过细胞外囊泡促进宿主全身抗病毒免疫