Anal Chem | 吉林大学胡良海教授/普渡大学陶纬国教授团队开发了高通量外泌体阵列用于蛋白质肿瘤标志物的原位检测
外泌体是一种细胞分泌的囊泡状结构小体,广泛存在于血浆、尿液等各种体液中,外泌体蛋白质组成及其翻译后修饰与疾病的发生发展有着密切的联系。由于受到磷脂双分子层膜的保护,外泌体中蛋白质的修饰形态更为稳定,因此能够更精确反应机体的生理和病理状态,是疾病标志物筛选的理想来源。由于体液样本参与人体内循环,其内容物相对复杂,以体液中的外泌体作为液体活检的目标具有一定的挑战性。
近日,吉林大学胡良海教授联合普渡大学陶纬国教授团队开了一种高通量的外泌体阵列用于蛋白质肿瘤标志物的原位检测,相关内容以“Supramolecular Exosome Array for Efficient Capture and In Situ Detection of Protein Biomarkers”为题发表在Anal Chem上(2023 Feb 7;95(5):2812-2821)。
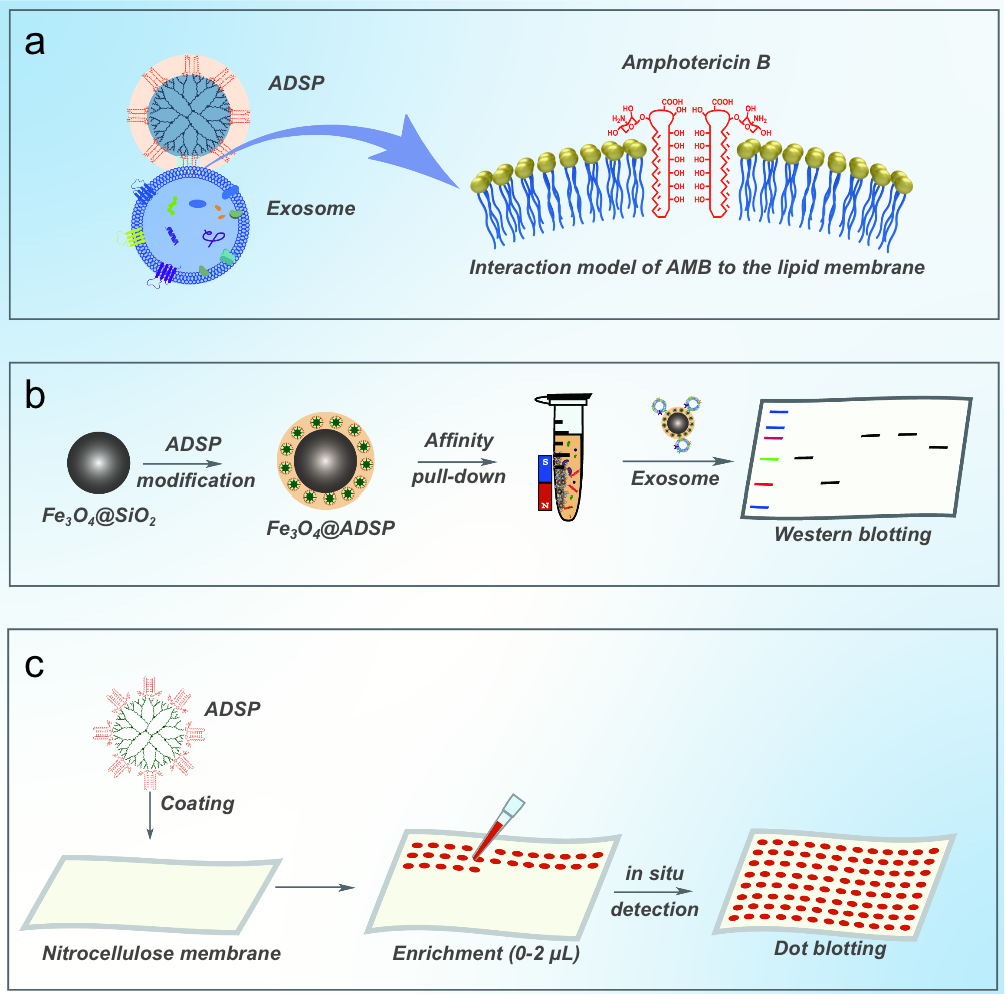
在该工作中,作者利用一种天然衍生的两亲性分子——两性霉素B,通过其多烯结构插入到蛋白质的脂质相中产生的范德华力和其他分子间力与脂质和甾醇相互作用作为分离外泌体的化学探针(ADSP)。并将AMB分子偶联到三维树状大分子上提供一个多价放大作用效果,从而能够有效地从复杂的体液中捕获外泌体,用于对高通量蛋白质组学发现的生物标记物的大规模验证。ADSP还可以修饰在磁珠或纤维素膜等各种载体上,实现从微量的临床样本中捕获外泌体的效果,为发现和验证用于癌症诊断和预后的蛋白质生物标志物提供了一个平台。
图 一, ADSP与外泌体磷脂膜的相互作用主要由两性霉素B与外泌体磷脂膜上的甾醇相互作用来提供,这种天然两亲性分子使其能够更有效地进行磷脂膜离子通道功能化。与具有高度的对称性和高度支化的树枝状大分子偶联,为AMB提供了均匀的多位点表面功能化。利用树枝状分子−AMB的超分子结构的多价效应,将ADSP修饰到磁性纳米粒子上可以实现体液中外泌体的高效快速富集,ADSP可以修饰在NC膜上,从而提供一种用于原位捕获和检测外泌体蛋白的阵列模式 。
图二,不同表面修饰的磁珠来富集临床常见体液(尿液、血浆、唾液、羊水和脑脊液)中的外泌体。ADSP修饰珠对所有体液均显示出显著的捕获效率(图二a)。另外两种外泌体标志蛋白(CD63和TSG101)也用于验证上述材料的特异性和效率均表现出有效的外泌体捕获(图二b)。为定量表征ADSP修饰的磁珠的捕获效率,采用DiO荧光法定量捕获后上清液中残留的外泌体。通过对外泌体膜进行染色。如图二c所示,ADSP磁性纳米颗粒的捕获效率最高(81%)与蛋白印迹结果一致。
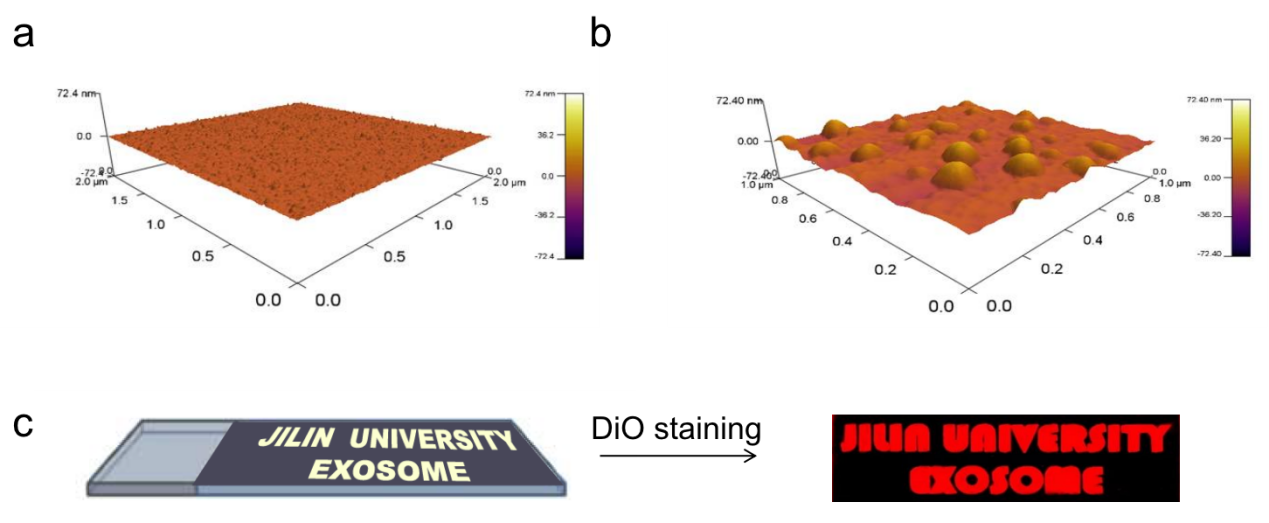
图三,与磁珠的合成类似,ADSP分子对载玻片进行修饰之后用于表征外泌体形貌。使用原子力显微镜(AFM)进行表征,提供了一个更精确的外泌体的大小分布、形态和力学性能。空白载玻片表面光滑,表明了该载玻片被ADSP探针有序修饰(图三a)。ADSP修饰的载玻片在与人血浆进行孵育后,可以看到捕获的直径为30~140nm的外泌体在载玻片上呈均匀分布(图三b)。为了在更宏观的尺度上可视化外泌体,载玻片通过图形涂层涂覆来进行更直接的评估,用图案化的载玻片富集外泌体后用荧光染料对捕获到的外泌体进行染色,通过近红外荧光成像系统进行扫描观察到“JILIN UNIVERSITY EXOSOME”图样在图三c中清晰可见,表明了外泌体的高效捕获。
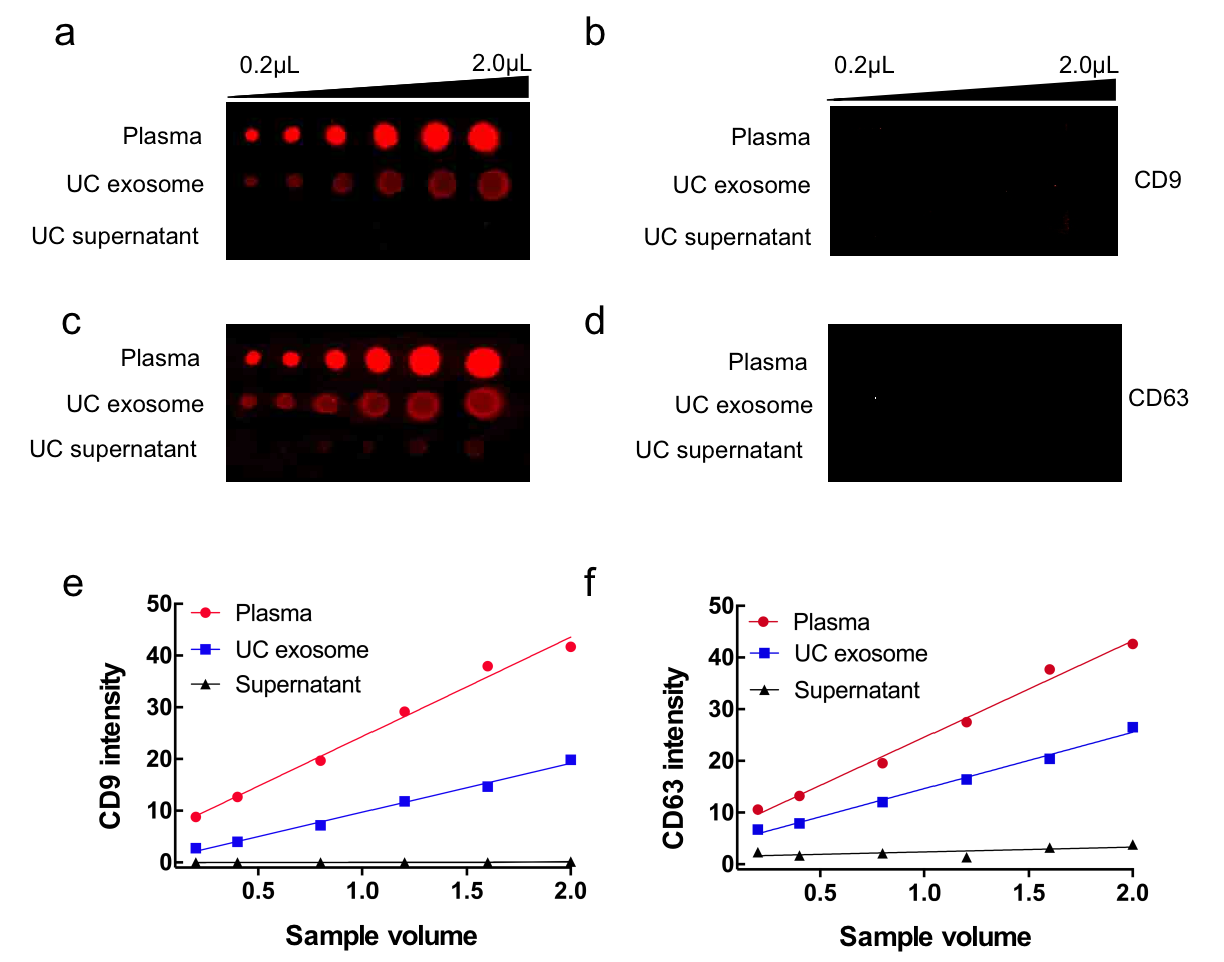
图四,为了检测ADSP的捕获效率和定量能力,使用ADSP修饰膜对0.2~2μL的血浆样品进行富集。作为对照,超速离心法(UC)分离的外泌体和UC上清液分别作为阳性对照和阴性对照进行分析。如图四a、c所示,直接点样血浆中的蛋白信号分别高出UC法得到的外泌体标志蛋白信号52%(CD9)和38%(CD63) 。此外,与UC外泌体样本相比,来自直接点样血浆的蛋白信号具有更佳的线性曲线(图四e、f)。除此之外,UC上清样本的血浆样本没有产生CD9或CD63的信号, 证明了高度丰富的蛋白质在血浆中没有引起假阳性影响。与没有ADSP涂层的膜(图四b,d)进行比较,空白膜上有没有可检测到外泌体标记蛋白的信号,进一步证明了ADSP阵列对外泌体的特异性吸附亲和力。
图五,使用36例肝细胞癌(HCC)患者和12例非癌症对照组的血浆样本(每例样本1μL)来验证ADSP修饰膜的外泌体阵列捕获。一种已知的各种癌症的标记蛋白——程序性细胞死亡配体1(PD-L1)和文献报道的HCC中潜在的标记蛋白——甘聚糖-1(GPC1)被选择为被检测的靶蛋白。如图五a、b所示,36例HCC患者中可以观察到强烈的PD-L1和GPC1信号。对于12个非癌症对照血浆样本,PD-L1和GPC1的信号非常弱甚至无法检测。这两种潜在的癌症标记蛋白在HCC患者血浆样本和非癌症对照组中检测到的信号差异非常显著(p < 0.0001)。除此之外Syntenin-1作为一种在不同细胞来源的外泌体中均高表达的蛋白,相对于CD9而言异质性更低因此在HCC样本与非癌症对照中差异不明显(如图五c、d)。
综上所述,该文章报告了一种基于外泌体的两亲性超分子探针的发展,可用于高效捕获外泌体以及进行原位高通量阵列分析。通过将ADSP超分子探针涂覆在NC膜上,可以实现基于阵列的高灵敏捕获和高通量检测一体化。相对于“金标准”超速离心法避免了超速离心过程中多步操作造成的样品损失,提高了外泌体的捕获效率。更重要的是,通过与基于质谱的蛋白质组学生物标志物的定量筛选相结合,这种超分子探针能够在未来为外泌体分析以及疾病生物标志物的鉴定提供新的平台。
【通讯作者简介】
胡良海,吉林大学“唐敖庆学者”领军教授,教育部“新世纪优秀人才计划”入选者,中国蛋白质组学专业委员会委员、中国质谱学会专业委员会委员。主要从事蛋白质组学新方法及其在生物医药中的应用研究。近年来,在基于外泌体的肿瘤标志物发现、药物靶标的蛋白质组学筛选方面取得了系列成果,在Angew. Chem. Int. Ed., Chem. Sci., Anal. Chem., TrAC, Theranostics等杂志上发表论文60余篇,他人引用2000余次,申请国家专利10余项(国际PCT专利1项),授权4项。
陶纬国,普渡大学、东南大学教授。美国普渡大学 (Purdue University) 化学博士(2001年)、美国系统生物研究所 (Institute for Systems Biology, Seattle) 博士后(2002年1月至2005年1月)。美国普渡大学助理教授 (2005-2010),终身教授(2011-2013),正教授(2014-2017)。中科院上海生命科学分院客座教授(2012 - )、北京理工大学客座教授 (2014 - )。 陶纬国博士和他的课题组从2005年以来一直从事生物质谱和蛋白质组学分析技术和方法的开发以及在研究疾病机理方面的应用,在蛋白质修饰,化学蛋白质组学,和细胞信号传递方面做出了一系列研究成果。针对蛋白磷酸化中的难点问题,开发了以质谱检测为中心的高通量新技术发现激酶的直接底物和磷酸蛋白的直接上游激酶,近年来致力于开发外泌体蛋白作为疾病指标分子。在国际科学期刊上发表SCI检索论文一百四十多篇,总引用率5500余次,并拥有多项专利。陶纬国获得2006年美国质谱学会的研究奖和2007年美国科学基金会 (NSF)的Early Career奖。参与并主持过多次美国质谱学会 (ASMS)的会议组织工作。目前担任北美华人质谱协会(CASMS)主席和美国人类蛋白组学会(USHUPO)的常委理事。
参考文献:
Supramolecular Exosome Array for Efficient Capture and In Situ Detection of Protein Biomarkers, Anal Chem. 2023 Feb 7;95(5):2812-2821. doi: 10.1021/acs.analchem.2c04190. Epub 2023 Jan 10.
外泌体资讯网 Anal Chem | 吉林大学胡良海教授/普渡大学陶纬国教授团队开发了高通量外泌体阵列用于蛋白质肿瘤标志物的原位检测