外泌体是直径最小的细胞外囊泡,直径为30–150 nm,通常分为细胞来源和体液来源。在过去的研究中,由于体积小、细胞毒性低、载药量高和耐受性好的优点,使用外泌体进行疾病治疗已经非常常见。乳源外泌体具有不同于细胞来源外泌体的特殊性质,近年来其作为口服给药系统的应用备受关注,其中大多数乳源外泌体来源于牛奶。
近日,陕西师范大学张媛团队在Food & Function杂志上发表了综述文章“Milk exosomes: an oral drug delivery system with great application potential” (oi: 10.1039/d2fo02013k),系统总结了牛乳外泌体的特征、分离技术、染色和标记技术、靶向修饰技术,并讨论了牛乳外泌体在载药和疾病治疗中的应用和前景。硕士研究生田梦园、郝东霞、刘洋为第一作者,张媛教授、李星教授为本文通讯作者。
牛乳外泌体的特征
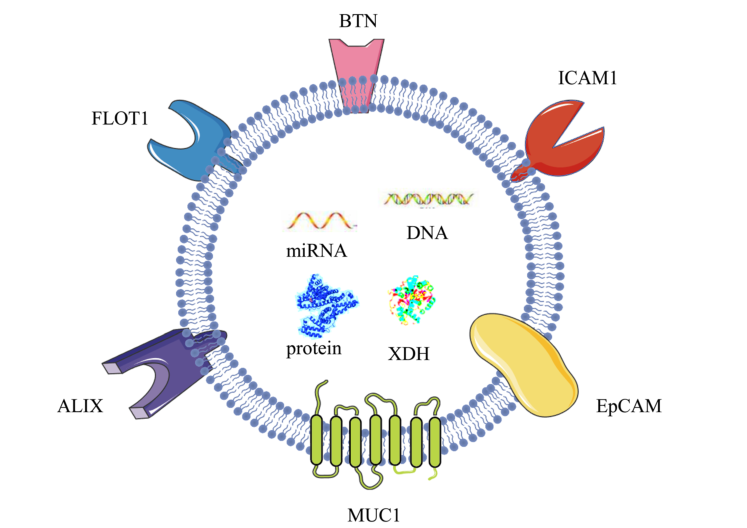
作为外泌体的一种,牛乳外泌体与其他外泌体具有共同的成分,最常见的包括Alix、Flillin1、四跨膜蛋白家族(CD9、CD63和CD81)、整合素和细胞粘附分子。此外,乳外泌体含有几种参与其形成的蛋白质。最常见的是testilin、 Rab GTPase和Tsg101,它们分别负责控制膜融合、与细胞骨架蛋白相互作用或参与内吞作用。牛乳外泌体还表达细胞骨架蛋白,如肌动蛋白、微管蛋白、丝蛋白、热休克蛋白和参与信号转导的分子。据报道,亲丁酸素、乳糖酶和黄嘌呤脱氢酶是牛乳外泌体的特异性标志物。
先前的研究表明,牛奶中含有mRNA、微RNA(miRNA)、核糖体RNA(rRNA)、长链非编码RNA(lncRNA)、转移RNA和可变DNA,牛奶中的mRNA主要分布在外泌体中,到目前为止,在牛乳外泌体内已检测到约19000个mRNA。
与其他来源的外泌体相比,牛乳外泌体具有一些独特的优势。由于其来源于牛奶,牛乳外泌体的抗性糖蛋白(包裹在外泌体膜中的XDH、BTN和MUC1)和表面蛋白(FLOT1、ICAM1、ALIX和EpCAM)使其对胃蛋白酶具有抗性并具有良好的稳定性。牛乳外泌体已被证明能耐受恶劣的环境,如胃酸、低pH值和高温,并可用作口服药物的输送载体。使用牛乳外泌体负载药物可以克服蛋白质类药物和一些小分子药物口服生物利用度低的局限性,与单独使用具有细胞毒性的抗癌药物相比还可以减少总剂量,降低药物毒性。此外,牛乳外泌体具有良好的跨膜转运能力,有助于它们克服肠上皮细胞屏障和血管内皮屏障,进入血液循环。
图:膜蛋白使牛乳外泌体稳定并对胃蛋白酶有抵抗力
牛乳外泌体的分离
根据外泌体不同的理化性质,分离外泌体的方法有很多种,现在广泛使用的方法有超速离心、尺寸排阻色谱、过滤、免疫亲和法和基于聚合物沉淀的方法。除上述常用方法外,根据不同原理开发的外泌体提取试剂盒、等电沉淀法、微流控技术等也逐渐应用于分离牛乳外泌体。目前,许多公司都在开发操作简单、准确度高的外泌体分离试剂盒。 2021年,Wijenayake等人的研究表明,相较于超速离心,ExoQuick沉淀试剂盒更适用于牛乳外泌体的分离。但牛乳外泌体的分离纯化并没有统一的标准,牛奶来源不同也会导致牛乳外泌体的差异。
牛乳外泌体的鉴定和标记
牛乳外泌体的鉴定方法通常分为两类,一类是定性鉴定,一类是定量鉴定。鉴定牛乳外泌体存在的最常用方法是蛋白质印迹。广泛用于蛋白质印迹的指标蛋白有 CD63、Tsg101、CD9、CD81、Alix 和 flotillin 1。纳米粒子跟踪分析技术(NTA)是近年来新兴的鉴定技术之一。它可用于检测外泌体的大小和浓度。动态光散射 (DLS) 是另一种测量外泌体理化性质的常用方法。全自动外泌体荧光检测和分析系统(ExoView® exosome kit)基于特定的免疫捕获技术,可提供包括外泌体粒径、计数、分布、蛋白表达、生物标志物共定位(CD9、CD81、CD63等)等外泌体表征信息。除了上述这些技术外,流式细胞术和基于抗体的外泌体阵列也用于鉴定牛乳外泌体。一些电子显微镜技术也可以检查外泌体的形状和大小,例如透射电子显微镜和原子显微镜。
目前,外泌体的标记方法有很多,包括亲脂性染料和透膜性化合物。常见的亲脂性染料是 PKH-67(绿色)和 PKH-26(红色)。两者都能稳定地结合细胞膜的脂质区域并发出荧光,主要用于细胞标记、体外增殖实验和体内外细胞示踪实验。亲脂性羰花青染料可以非共价插入外泌体膜,进入脂质双层后,它们可以扩散到整个表面。 DiO、DiI、DiR和DiD是一个系列可以染色细胞膜和其他脂溶性生物结构的常见亲脂性羰花青染料。透膜性化合物CFSE(羧基荧光素二乙酸琥珀酰亚胺酯)可以被动扩散到细胞中。该试剂没有颜色或荧光。进入细胞后,与细胞质中的酯酶结合,产生明亮的荧光。除了上述方法外,还有许多其他方法可用于标记外泌体,包括构建荧光蛋白或荧光素酶,以及利用某些物质的物理特性来标记外泌体,例如量子点、放射性同位素或磁共振成像造影剂 SPIO。
牛乳外泌体的靶向修饰
常见的牛乳外泌体修饰方法是在外泌体表面交联叶酸或者透明质酸。由于叶酸受体在多种肿瘤细胞表面高度表达,叶酸常被用于外泌体靶向癌细胞的配体。Munagala等人在研究用于肿瘤治疗的载药牛乳外泌体时使用叶酸修饰了装载有维生素A(WFA)的牛乳外泌体。结果表明,用叶酸修饰的载药外泌体提高了药物的口服生物利用度,同时显著抑制肿瘤生长。2020年,Wu等人发表了一项关于用阿奇霉素和DSPE-PEG2000-HA修饰牛乳外泌体并装载多柔比星(Dox)的研究。体外分析结果证实,HA-Exo-Dox与乳腺癌症和肺癌癌症细胞具有较高的结合率,用其处理的癌症细胞的存活率远低于用相同浓度的游离Dox处理的癌症细胞。
由于牛乳外泌体膜源自细胞膜,脂质体膜的设计也模拟细胞膜,因此脂质体的许多修饰方法也可以应用于外泌体。点击化学是一种修饰外泌体的新技术。其原理是炔基通过1-乙基-3-(3-二甲基氨基丙基)碳二亚胺N-羟基琥珀酰亚胺(EDC-NHS)缩合反应与外泌体连接。点击化学反应的反应时间短,并且可以在水性缓冲液和有机溶剂中进行。偶联反应对外泌体的大小和靶细胞的摄取没有影响。近年来,无铜点击化学反应也很流行,其中包括由张力促进的叠氮炔环加成(SPAAC)反应和Diels-Alder(iEDDA)反应,其可以在含水条件下快速且特异地进行化学偶联。通过无铜点击化学反应检测小分子叠氮化物比通过铜催化反应更快,并且由于不需要铜离子,因此毒性更低。
非共价修饰包括多价静电相互作用、疏水相互作用、锚定细胞穿透肽(CPPs)等。CP05肽对CD63上氨基酸残基的胞外环具有很强的亲和力,因此它可以很好地连接靶向治疗部分和外泌体表面。如今,研究人员可以直接将治疗药物与CP05肽融合,而无需将药物装载到外泌体中。为了根据环境条件将外泌体的特定释放,还可以将能够响应相应pH、温度等的部分引入外泌体膜中。
牛乳外泌体的治疗应用
药物递送系统一直是当前研究的热点,其根源在于传统治疗药物和给药方法难以治疗某些疾病。金属纳米颗粒(NP)、碳基纳米颗粒和聚合物纳米颗粒的应用受到金属毒性、缺乏靶向性和在全身循环中快速去除的限制。树突细胞衍生的外泌体会引起患者炎症,尤其是癌症患者,因为它们含有肿瘤抗原,可以诱导特定的炎症反应。骨髓间充质干细胞衍生的外泌体的优点包括低免疫原性、减少组织损伤和易于永生而不影响外泌体生产。然而,在测试外泌体的安全性时,MSC衍生外泌体永生化活性增加了潜在的致癌风险。牛乳外泌体由于自身性质,作为药物载体系统具有许多特殊优势。首先,除了生物相容性和生物降解性,牛乳外泌体的毒性和免疫原性也很低。牛乳外泌体内具有抗癌活性,作为口服制剂,它们还可以减少炎症。其次,由于接触表面积增加,牛乳外泌体可以增加药物的溶解度。牛乳外泌体可以防止胃酸、低pH环境和胃蛋白酶的影响,从而避免药物在胃肠道中的降解,提高其稳定性。第三,研究表明牛乳外泌体可以保护巨噬细胞免受化疗药物顺铂诱导的细胞毒性。与纯药物给药相比,牛乳外泌体可降低抗癌药物的毒性。最后牛乳外泌体在血液中也表现出优异的稳定性,在生理和病理条件下可以在体内长距离扩散,增加血液循环中的药物循环时间。更加引人注目的是,低产量是细胞来源外泌体无法克服的瓶颈,而相比之下牛乳外泌体的产量惊人。据报道,通过差速离心和过滤,外泌体的产量可达到每升牛奶200毫克。
先前的研究表明,蛋白类药物和小分子药物等物质可以通过不同的方法装载到牛乳外泌体中或外泌体膜上。最常见的方法是共孵育、电穿孔、循环冻融、透析以及使用表面活性剂等。乳源外泌体的药物装载率与药物装载方法和外泌体来源的不同有关,然而,牛乳外泌体的装载率和包封率通常不够高,这是当牛乳外泌体用作药物载体时必须考虑的问题。迄今为止,牛乳外泌体作为药物载体已被应用于治疗许多疾病,其中包括肺癌、糖尿病、乳腺癌、卵巢癌、口腔鳞状细胞癌,成功装载的药物包括姜黄素、花青素、紫杉醇、雷公藤红素、表儿茶素没食子酸酯、胰岛素、miRNA等。
牛乳外泌体不仅可以作为药物载体治疗疾病,而且对某些疾病也有预防和治疗作用。例如,牛乳外泌体会抑制DNMT1和DNMT3这两个基因表达,从而预防结直肠癌。此外,研究表明牛乳外泌体具有抗炎作用。牛乳和母乳外泌体对结肠炎也有特定的治疗作用,牛奶初乳来源的外泌体(Col-exo)可激活结肠上皮细胞增殖和巨噬细胞增殖,有效消除活性氧,调节免疫细胞因子的表达并减轻炎症,从而对小鼠结肠炎模型具有治疗作用。此外,对小鼠关节炎模型的研究表明,牛乳外泌体可以减缓关节炎的发作,减少软骨损失和骨髓炎症。2022年Yenuganti等人的研究证明了牛乳外泌体和羊乳外泌体的抗病毒能力,为基于乳源外泌体治疗病毒性疾病的研究开辟了一条新途径。
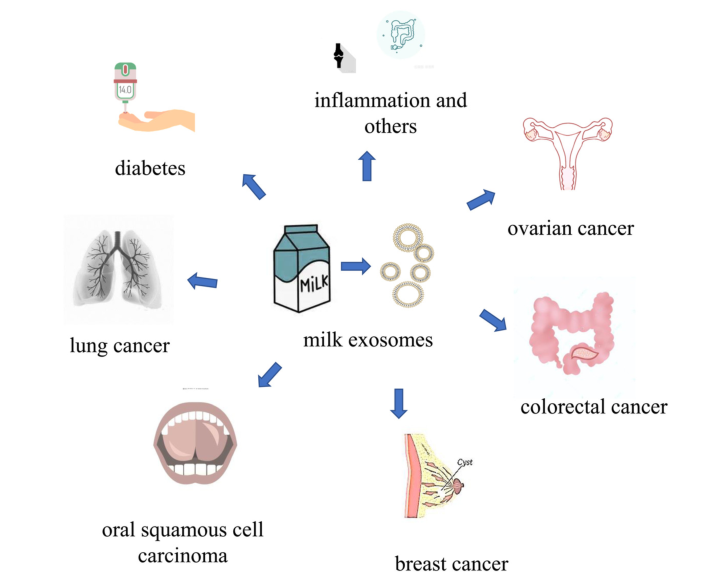 |
图:牛乳外泌体在疾病治疗中的应用
总结和未来展望
总之,牛乳外泌体具有许多特点和独特的优势。先前的研究已经充分证明,牛乳外泌体在抗炎症等临床应用方面具有巨大潜力,可以用作癌症预防和治疗的生物标记物和药物载体。越来越多的证据证实,牛乳外泌体是一种有前途的药物递送纳米载体,可提高药物的安全性、生物利用度,以及将过去的高毒性非口服药物递送和转化为更稳定和安全的口服制剂的有效性。同时,带有肿瘤靶向配体的外泌体也可以增强肿瘤靶向递送,从而实现对癌症的治疗效果。然而,牛乳外泌体的应用仍受到许多限制,并不适用于大规模生产和广泛应用。如今,对牛乳外泌体的研究仍处于混乱和初步阶段,作为一种新型纳米载体,它在未来将具有巨大的应用潜力。
参考文献
Milk exosomes: an oral drug delivery system with great application potential. Food Funct. 2023 Jan 26. doi: 10.1039/d2fo02013k.
外泌体资讯网 Food & Function | 陕西师范大学张媛团队综述:牛乳外泌体——具有巨大应用潜力的口服药物递送系统