胞外囊泡(extracellular vesicles,EVs)是一种备受关注的液体活检标志物,其携带了母细胞的分子信息(如蛋白质、脂质、代谢产物和核酸),被视为细胞间通讯的媒介。在肿瘤微环境(tumor microenvironment, TME)中,肿瘤细胞和肿瘤相关细胞(tumor-associated cells, TACs)之间通过EV进行通迅,在癌症的生长、侵袭和转移中发挥着关键作用。因此,源自肿瘤微环境的循环EVs(称为cTME-EVs,包括肿瘤细胞和TAC衍生EVs)是一种独特的癌症标志物。全面地分析和鉴定cTME-EVs将促进肿瘤微环境的基础研究和推动临床诊断。然而,由于缺乏从体液中选择性富集cTME-EVs的有效手段,cTME-EVs的相关研究比较缓慢。
近日,南开大学化学学院的刘定斌课题组开发了一种从血清中选择性分离富集cTME-EVs的技术平台。这一成果以直接投稿的方式(direct submission)发表在美国科学院院刊Proc. Natl. Acad. Sci. U.S.A.(2023, 120, e2214912120)上。该论文的第一作者是南开大学化学学院的宗志友博士,刘定斌教授是论文的唯一通讯作者。该项目获得国家重点研发计划和国家自然科学基金的资助。
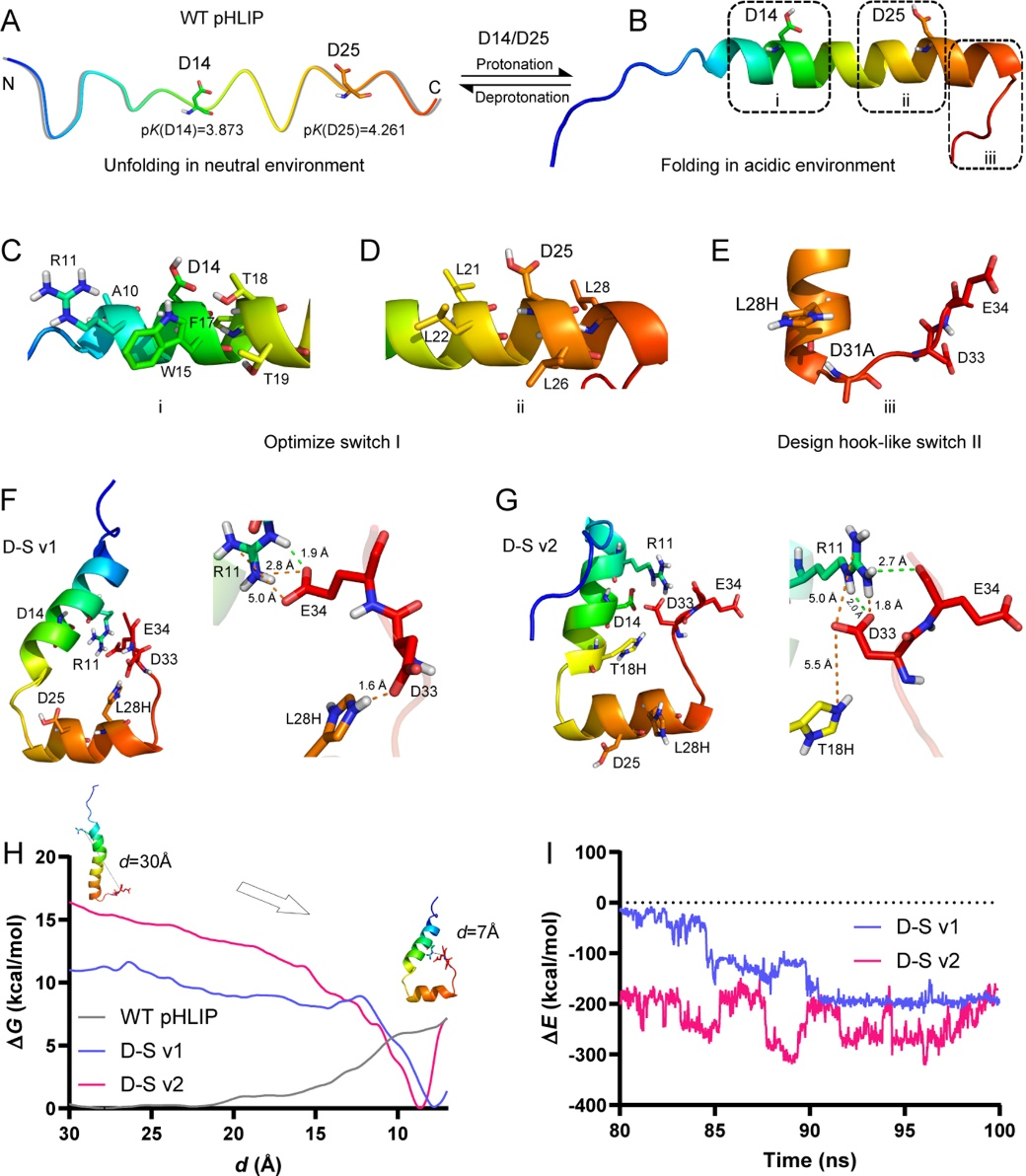
在这项工作中,他们设计了一种双开关pH响应肽(简称D-S pHLIP),能特异性地插入cTME-EVs中,再结合磁分离策略,选择性地从血清中分离富集cTME-EVs。为了优化pHLIP固有的pH驱动开关,以有效靶向TME,他们首先借助于H++软件,确定了改造区域,并在这些位点上通过虚拟饱和突变设计了200多个变体;构建了相关的三维结构,以计算突变对D25和D14的pK增量的影响。接下来,他们创建一种新型的pH驱动钩状开关,并借助分子动力学模拟、自由能计算、相互作用能计算等研究突变对pHLIP结构和性能的影响(图1)。
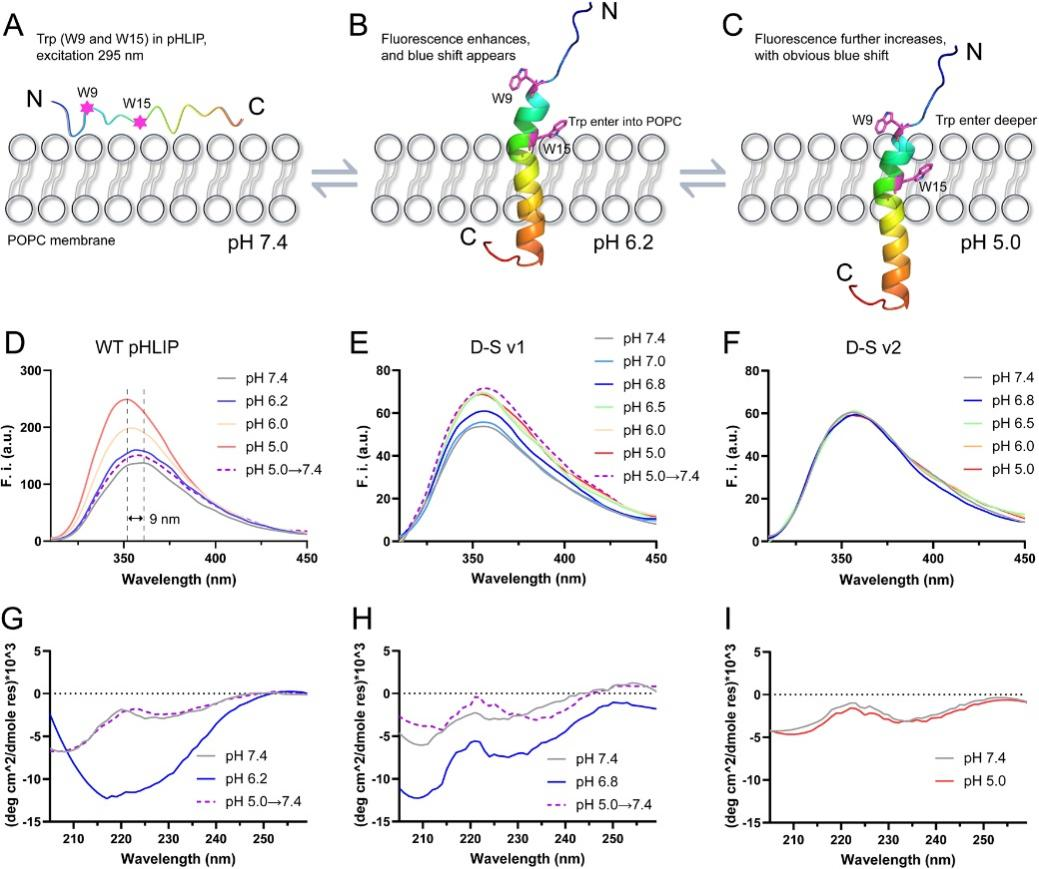
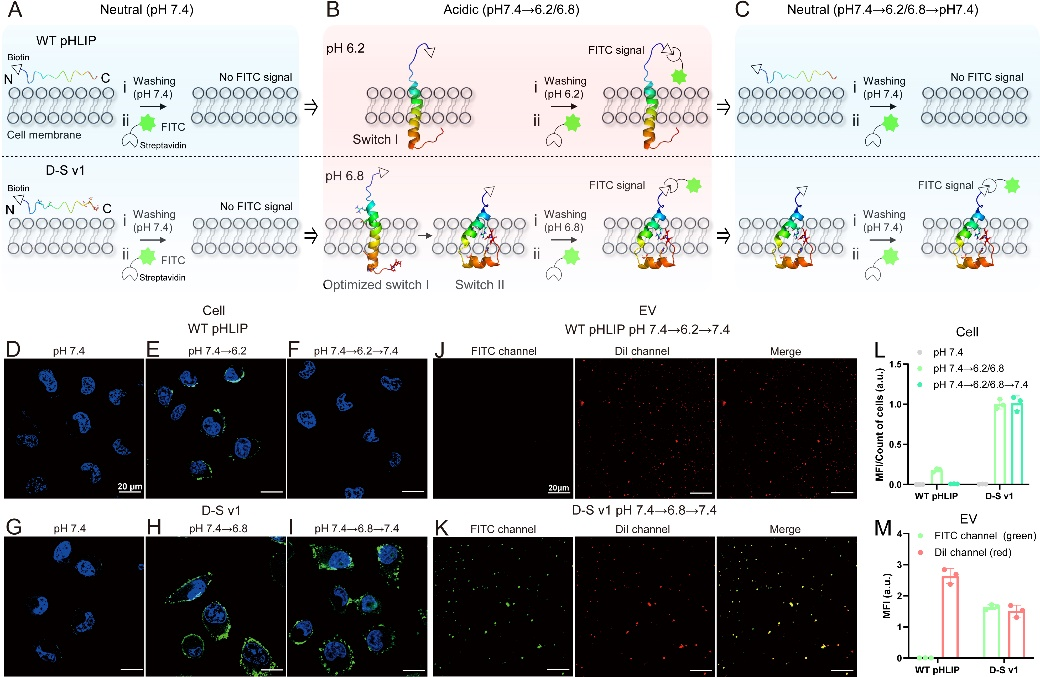
为了研究D-S pHLIP的实际性能,他们通过记录Trp荧光(pHLIP中的W9和W15,在295 nm处激发),使用POPC膜验证了这些多肽的插入行为(图2)。实验结果表明,只有D-S v1突变体满足高灵敏度TME靶向和在cTME-EVs上不可逆插入的要求,即,i)在pH 6.8下折叠成螺旋结构插入到cTME-EVs中; ii)在pH值恢复到中性的体循环中(pH 7.4),依然牢牢地“锁定”在EV膜中。细胞膜成像和相应的EV成像实验验证了他们的实验设计结果(图3)。
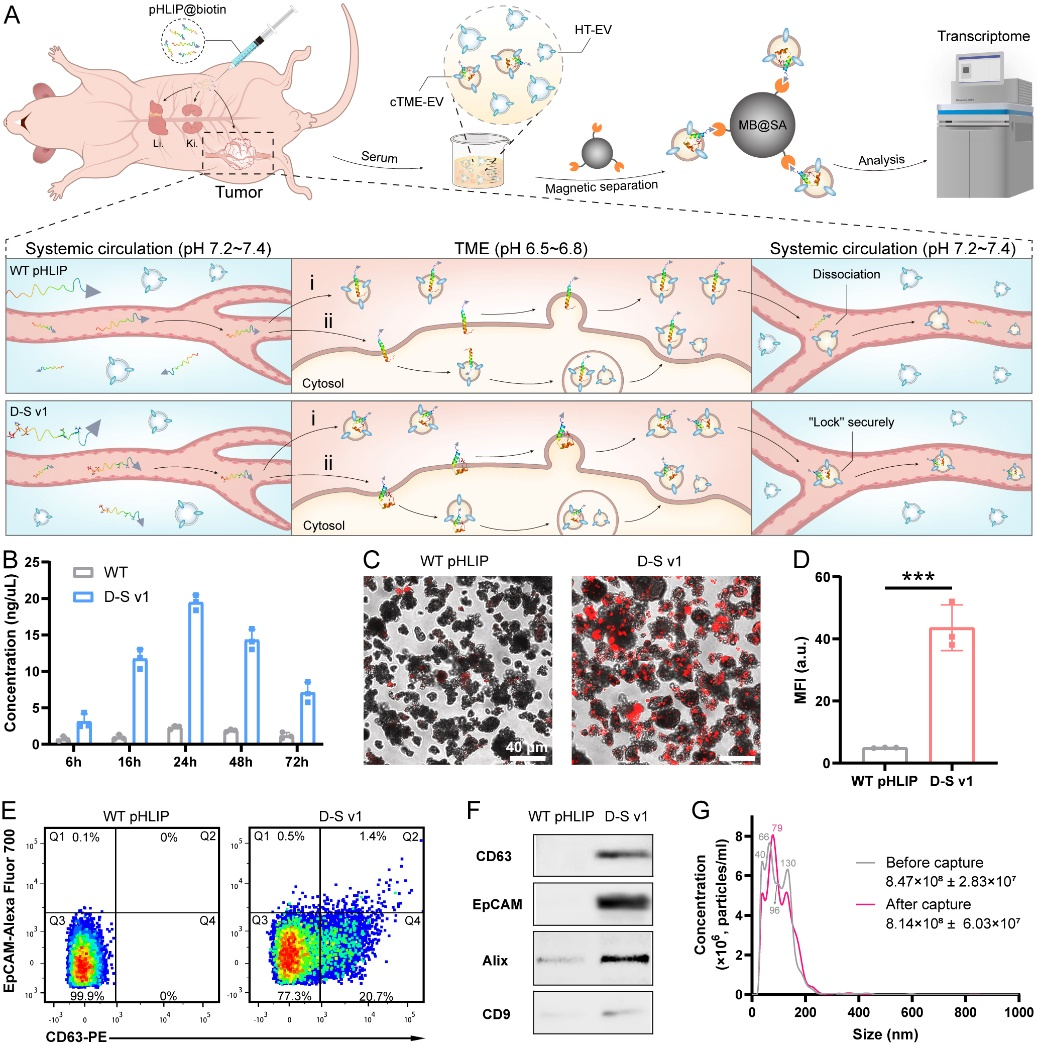
为了验证该D-S pHLIP系统从动物模型血清中选择性富集cTME-EVs的可行性,他们将生物素(biotin)修饰的多肽通过腹腔注射到肿瘤模型小鼠体内。在注射后6、16、24、48和72小时收集小鼠的血清,并通过链霉亲和素修饰的磁珠(MB@SA)进行分离富集cTME-EVs(图4)。总RNA分析结果显示,注射多肽后24 h时收集到最多的cTME-EVs;共聚焦荧光成像显示磁珠上富集了大量EVs;流式细胞术结果表明我们捕获到了大量的EVs,并通过与肿瘤标志物EpCAM共定位,表明其的确是肿瘤来源的EVs;western blot结果验证了他们捕获到的EVs确实源自肿瘤;NTA分析结果表明,血清中的cTME-EVs约占所有EVs的3.9%。
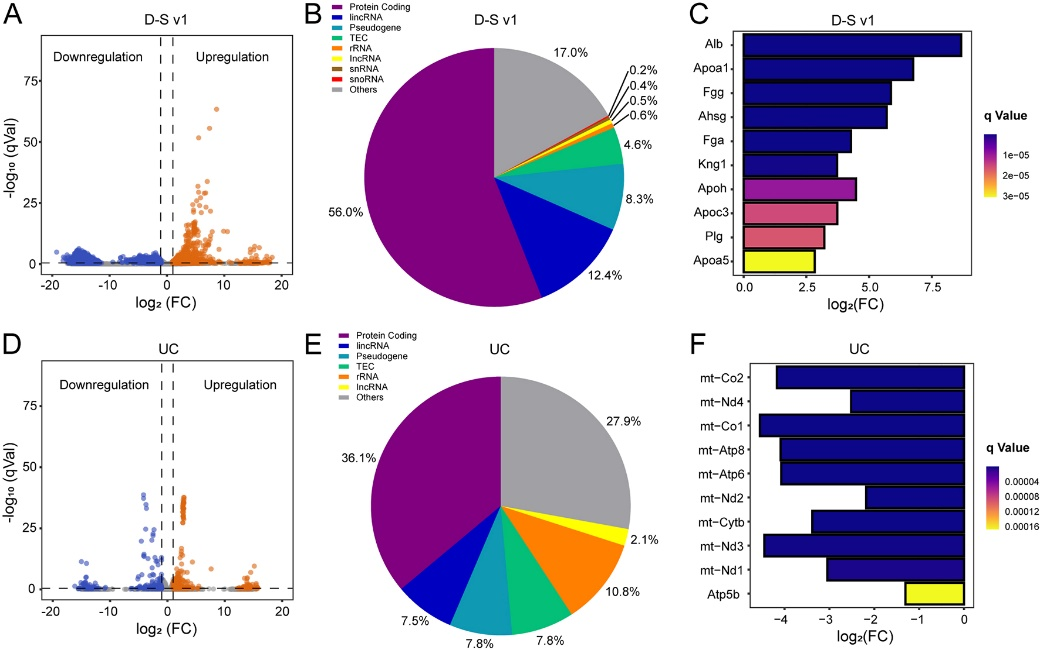
最后,他们利用转录组进一步验证了该分离平台在遗传水平上的可用性,并揭示了这些捕获的cTME-EVs的细胞来源。超速离心法是分离EV的标准方法,被用作对照。他们从患有肺癌的小鼠和健康小鼠中分离EVs,并进行下游转录组学的研究(图5)。他们在D-S pHLIP组中鉴定出6256个差异基因(DEG),包括448个上调基因和5808个下调基因;而在超速离心组中,仅发现了332个DEG(243个上调和89个下调)。除了数量,火山图(图5A和5D)显示,D-S pHLIP组中的DEG比UC组具有更显著的差异。此外,在D-S v1组中,首次鉴定出了一些显著上调的hub基因(包括Alb、Kng1等),可用作潜在的肿瘤生物标志物,并可以据此进一步开发癌症的治疗靶点。
现阶段,在基于EV的液体活检和癌症研究中,有几个难以解决的问题,限制了这一领域的发展。例如,如何将微弱的癌症相关信号与正常人体生理的背景噪声区分开来,尤其是在癌症早期?如何阐明TME对肿瘤发展的贡献,并进一步开发TME相关的诊断和治疗策略?通过开发选择性分离富集技术、全面鉴定cTME-EVs,为解决上述问题提供了前所未有的机会。刘定斌教授所领导的团队开发的D-S pHLIP系统突破了从癌症相关体液中选择性富集cTME-EVs的困境,为肿瘤标志物的发现和EV的溯源提供一种全新的平台。此外,通过在D-S pHLIP的N端修饰染料或药物,可用于肿瘤精准成像和TME靶向药物递送,具有巨大的临床应用价值。
通讯作者简介
刘定斌,国家海外人才计划入选者。2006年本科毕业于兰州大学,2012年博士毕业于国家纳米科学中心(师从蒋兴宇教授),随后在美国国立健康研究院(师从Shawn Chen教授)开展疾病检测研究;2014年加入南开大学化学学院,任研究员/教授、药物化学生物学国家重点实验室体外检测与分子影像研究室课题组长(PI)。近年来,已在包括PNAS、JACS、JACS Au、Angew. Chem.、Nano Lett.等国际著名期刊上发表生物检测和临床诊断相关论文90余篇,已获授权专利十余项,并实现了部分专利的成果转化。主持国家重点研发计划课题1项和国家自然科学基金面上项目4项(已结题2项);荣获中华医学会青年科技奖;担任国际医学杂志Nanotheranostics副主编/编委和《高等学校化学学报》青年编委。
刘定斌课题组长期招聘助理研究员、博士后和科研助理,提供极具诚意的薪酬,享受南开大学和天津市相关政策待遇。欢迎对生物医学检测有浓厚兴趣且具有医学、生物或化学背景的同学联系(邮箱:liudb@nankai.edu.cn)。